Định nghĩa, phổ bệnh lý, và tần suất của hội chứng không có lá van động mạch phổi
Hội chứng không có lá van động mạch phổi (APVS) là một dị tật tim hiếm gặp đặc trưng bởi tình trạng các lá van động mạch phổi không có, loạn sản, hoặc sơ khai, có liên quan đến thông liên thất đường thoát và động mạch chủ cưỡi ngựa (Hình 25.30) (33). Tình trạng này cũng được gọi là TOF kèm không có lá van động mạch phổi (33). Hầu hết các trường hợp APVS cũng liên quan đến không tồn tại ống động mạch, tình trạng không có ống động mạch này được coi như là nguyên nhân bệnh sinh của APVS (14). Động mạch phổi chính, trái và phải trở nên giãn nặng và vòng van động mạch phổi chính thấy dấu hiệu hẹp và suy nặng. Đặc điểm lâm sàng khác bao gồm mối liên quan phổ biến với bất thường đường thở, bất thường này có thể dẫn đến suy hô hấp nặng. Một biến thể hiếm gặp của APVS được báo cáo với vách liên thất nguyên vẹn, thân động mạch phổi giãn ít, và tồn tại ống động mạch.
APVS thường được phân loại như một phân nhóm của TOF (33). Tỷ lệ phát sinh APVS là hiếm gặp và nó được ước tính khoảng 3 – 6% trong tổng số TOF và 0.2 đến 0.4% trẻ sinh sống mắc bệnh tim bẩm sinh (2, 35). Tỷ lệ phát sinh APVS cao hơn ở thai nhi sống và được báo cáo trong một số nghiên cứu loạt ca (36-41). Hình 25.31 Minh họa giải phẫu tử thi của một tim thai bị APVS.
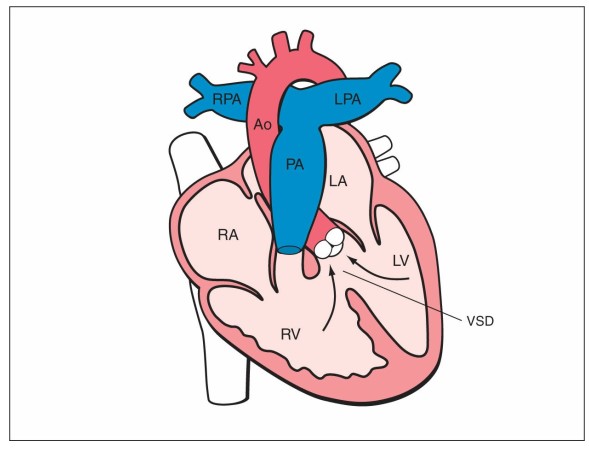
Hình 25.30: Sơ đồ mô tả của hội chứng không lá van động mạch phổi. Xem bài viết để có chi tiết. LA, nhĩ trái; RA, nhĩ phải; LV, thất trái; RV, thất phải; RPA, động mạch phổi phải; LPA, động mạch phổi trái; Ao, động mạch chủ; PA, động mạch phổi, VSD, thông liên thất.
Hình 25.31: Giải phẫu tử thi của tim thai bị hội chứng không lá van động mạch phổi, thấy đường thoát thất phải bị đóng kèm thông liên thất lớn (VSD). Khu vực vong van động mạch phổi thấy không có lá van động mạch phổi (mũi tên trong), động mạch phổi phải (RPA) và động mạch phổi trái giãn. AO, động mạch chủ; LV, thất trái; RV, thất phải.
Các dấu hiệu siêu âm
Trắng đen
Trong APVS, mặt cắt 4 buồng có thể dường như bình thường nhưng có thể chỉ thấy giãn thất phải đo quá tải thể tích từ suy van động mạch phổi, đặc biệt ở tuổi thai muộn. Mặt cắt 5 buồng thấy VSD kèm động mạch chủ cưỡi ngựa, nhưng trong APVS, ngược lại với TOF cổ điển, gốc động mạch chủ không giãn (Hình 25.32). Mặt cắt trục ngắn hoặc mặt cắt 3 mạch máu-khí quản thấy động mạch phổi chính, nhánh phải và nhánh trái giãn rất lớn (Hình 25.33 đến 25.36). Thay vì đường kính nhánh động mạch phổi và thân từ 2 đến 6mm, có thể ghi nhận giá trị từ 10 đến 18mm. Trong hầu hết các trường hợp, không tìm thấy ống động mạch (36) (Hình 25.33). Động mạch chủ xuống có thể thấy bên phải và giữa cột sống trong trường hợp cung động mạch chủ bên phải.
Hình 25.32: Mặt cắt ngang 5 buồng tim của thai nhi mắc hội chứng không lá van động mạch phổi (APVS) thấy thông liên thất (VSD) kèm động mạch chủ (AO) cưỡi ngựa, tương tự như tứ chứng Fallot kèm teo van động mạch phổi với thông liên thất đã được giải thích trong chương này. Đặc điểm phân biệt của APVS bao gồm giãn lớn động mạch phổi phải (RPA) được thấy trong mặt cắt này. Động mạch chủ cưỡi ngựa không giãn như trong tứ chứng Fallot hoặc trong teo van động mạch phổi kèm VSD. LV, thất trái; RV, thất phải.
Hình 25.33: Mặt cắt 4 mạch máu trên siêu âm trắng đen (A) và siêu âm Doppler màu (B) ở thai nhi bị hội chứng không lá van động mạch phổi. Lưu ý sự hiện diện động mạch phổi phải (RPA) và động mạch phổi trái (LPA) giãn nặng ở hình A. Thường không thấy ống động mạch không thấy và van động mạch phổi (PV).
Doppler màu
Các dấu hiệu chính trên Doppler màu và Doppler xung là đặc trưng và bao gồm vận tốc qua vòng van động mạch phổi cao (hình 25.33), với dòng chảy “tới và lui” (to-and-fro) điển hình, bởi vì dấu hiệu của hẹp và suy van nặng (Hình 25.34 và 25.35). Vận tốc khoảng 200 đến 250 cm/s thường được ghi nhận qua van động mạch mạch phổi chính trên đánh giá phổ Doppler (Hình 25.35). Doppler màu có thể cũng thấy hở van 3 lá.
Thai sớm
Đặc điểm chính của APVS là động mạch phổi giãn lớn, dấu hiệu này có thể không rõ ràng trước tuổi thai 22 tuần (39). Do đó, không có gì lạ khi thấy động mạch phổi kích thước bình thường ở những thai nhi bị APVS ở tuổi thai sớm. Các bất thường giải phẫu và huyết động tiến triển đáng kể trước sinh, và hình ảnh đầy đủ APVS có thể không được biểu hiện cho đến cuối thai kỳ (42).
Hình 25.34: Doppler màu trong thì tâm thu (A) và tâm trương (B) ở thai mắc hội chứng không lá van động mạch phổi và biểu hiện động mạch phổi phải (RPA) và động mạch phổi trái (LPA) đặc trưng. Trong thì tâm thu (A), dòng máu xoáy chảy từ thất phải (RV) qua vòng van động mạch phổi với lá van động mạch phổi không có hoặc dạng di tích vào LPA và RPA (mũi tên xanh). Trong thì tâm trương, dòng máu chảy ngược (mũi tên đỏ) từ các động mạch phổi vào RV. Lưu ý màu aliasing ở hình A và B, đây là một dấu hiệu vận tốc cao.
Hình 25.35: Doppler xung qua van động mạch phổi loạn sản hoặc không có ở thai nhi bị hội chứng không lá van động mạch phổi. Phổ Doppler qua động mạch phổi (PA) chứng minh dòng chảy “tới và lui” (to-and-fro) do biểu hiện trên Doppler màu và phổ Doppler. Lưu ý vận tốc cao (>150) trong thì tâm thu và tương ứng với tình trạng hẹp và hở.
Khó chẩn đoán APVS trong tam cá nguyệt thứ nhất, nhưng bệnh cảnh này được báo cáo ở tuổi thai sớm (42) với hở van động mạch phổi là đặc điểm siêu âm duy nhất. Sự tăng độ mờ da gáy được ghi nhận lên tới 40% thai nhi mắc APVS trong một số nghiên cứu loạt ca, và điều này có thể tạo điều kiện thuận lợi cho việc nhận ra hội chứng này ở thai sớm (39). Dòng chảy đảo ngược cuối tâm trương của động mạch rốn được ghi nhận ở 5 trong tổng số 614 thai nhi trong một nghiên cứu tiền cứu từ 10 và 14 tuần; 3 trong 5 thai nhi này măc TOF loại APVS và còn ống động mạch (43).
Hình 25.36: Siêu âm 3D ở chế độ hiển thị bề mặt thấy động mạch phổi phải (RPA) và động mạch phổi trái (LPA) giãn ở hình A. Hình B và C ở chế động glass-body với dòng chảy 2 chiều qua van động mạch phổi (PV). RV, thất phải; PA, động mạch phổi.
Siêu âm 3D
Ứng dụng hình ảnh cắt lớp 3D cho phép nhận ra các tâm thất hơi khác biệt ở mặt cắt 4 buồng tim cũng như các động mạch phổi giãn nặng (Hình 25.36). Kết hợp Doppler màu và hình ảnh cắt lớp 3D thấy dòng chảy xoáy mạnh qua đường thoát thất phải (Hình 25.36).
Các dấu hiệu tại tim và ngoài tim liên quan
Các dấu hiệu tại tim bao gồm cung động mạch chủ bên phải. Biến thể động mạch vành cũng tồn tại với APVS.
Các dấu hiệu ngoài tim bao gồm liên quan nhiều đến các bất thường nhiễm sắc thể, chủ yêu mất đoạn nhỏ 22q11 (14, 36, 39). Mối liên quan này theo thứ tự từ 20% đến 50% thai nhi bị APVS (36, 39-41). Các bất thường nhiễm sắc thể khác có thể được tìm thấy nhưng thường liên quan với sự hiện diện của dị tật ngoài tim. Biển thế APVS với tồn tại ống động mạch hiếm khi liên quan đến bất thường nhiễm sắc thể và bất thường ngoài tim (39-41). Liên quan phổ biến và nghiêm trọng của APVS là chứng nhuyễn phế quản (bronchomalacia), chủ yếu do đè ép phế quản bởi giãn thân động mạch phổi (41, 44). Tình trạng này có thể không được chẩn đoán tiền sản nhưng nên được giải thích trong tham vấn bố mẹ thai nhi.
Chẩn đoán phân biệt
APVS được chẩn đoán dễ dàng khi dấu hiệu đặc trưng của giãn phình động mạch phổi trên siêu âm. Tuy nhiên, chẩn đoán phân biệt của động mạch chủ cưỡi ngựa được trình bày Bảng 25.3.
| Bảng 25.3 Chẩn đoán phân biệt của một mạch máu lớn cưỡi ngựa qua thông liên thất (VSD) | ||
| Gợi ý chẩn đoán | Dấu hiệu thêm vào | |
| Tứ chứng Fallot | · PA rõ, hẹp
· Dòng chảy xuôi dòng trong PA |
· Dòng chảy xuôi dòng hoặc ngược dòng trong DA |
| Hẹp động mạch phổi kèm VSD | · PA rất hẹp
· Không có dòng chảy xuôi dòng trong PA |
· DA ngoằn ngoèo với dòng chảy ngược dòng |
| Không có lỗ van động mạch phổi | · PA rất lớn
· Dòng chảy tới và lui trong PA |
· Thường không có DA
· Gốc động mạch chủ nhỏ hơn PA |
| Thân chung động mạch | · PA xuất phát từ mạch máu cưỡi ngựa | Van của mạch máu cưỡi ngựa có thể có dòng hở |
| Thất phải 2 đường ra | PA cưỡi ngựa và động mạch chủ đi song song | Giống với TGA (TGA) kèm VSD |
PA, Động mạch phổi; DA, ống động mạch; TGA: chuyển vị đại động mạch; VSD: thông liên thất
| Bảng 25.1: Các đặc điểm phân biệt của 3 phân nhóm trong tứ chứng Fallot | |||
| TOF 1 hẹp động mạch phổi | TOF 1 teo van động mạch phổi | TOF 1 không lá van động mạch phổi | |
| Mặt cắt 4 buồng | Bình thường | Bình thường | Thất phải giãn, đặc biệt ở tuổi thai lớn |
| Mặt cắt 5 buồng | VSD + ĐMC cưỡi ngựa | VSD + ĐMC cưỡi ngựa | VSD + ĐMC cưỡi ngựa |
| Gốc động mạch chủ | Giãn + | Giãn ++ | Kích thước bình thường |
| Động mạch phổi | Hẹp, dòng chảy xuôi dòng | Rất hẹp, hoặc thậm chí không thấy, dòng chảy ngược dòng | Giãn nặng với dòng chảy tới và lui |
| Ống động mạch | Dòng chảy xuôi dòng hoặc ngược dòng. Cung động mạch chủ bên phải, ống động mạch khó thấy vì nó nằm dưới cung động mạch chủ | Giãn ngoằn ngoèo với dòng chảy ngược dòng | Thường không thấy |
| MAPCAs | Ít gặp | Hiện diện hơn 20% các trường hợp | Không có |
| Tiên lượng | Tốt | Thận trọng | Thận trọng |
| Mất đoạn 22q11 | 10-15% | 20-25% | 30-40% |
MAPCAs, động mạch phụ thêm chủ phổi; RV, tâm thất phải; VSD, thông liên thất
Tiên lượng và kết cục
APVS được chẩn đoán tiền sản thường đại diện kết thúc một chuỗi nặng và thường đi kèm kết cục xấu. Tỷ lệ sống được cáo theo thứ tự 15% và 20% như trong các nghiên cứu (39-41). Tỷ lệ tử vong cao liên quan đến cả suy tim và chứng nhuyễn phế quản (bronchomalacia) (41). Xuất hiện cùng chứng nhuyễn phế quản thường có tim to và giãn động mạch phổi nặng, đây là dấu hiệu tiên lượng xấu. Tham vấn tiền sản nên tính đến tiến triển của tổn thương này trong tử cung. Thai nhi với tồn tại ống động mạch và các động mạch phổi ít giãn có thể có kết cục tốt hơn. Số liệu gần đây cho thấy kết cục lâu dài tích cực của các thai nhi mắc APVS. Tỷ lệ sống sót chung sau 5 năm và 10 năm là 92,4% được báo cáo trong một nghiên cứu loạt ca 42 bệnh nhân được phẫu thuật sửa chữa với tỷ lệ sống sót là 72% và 100% tương ứng với bệnh nhân bị suy hô hấp và không bị suy hô hấp (45). Nghiên cứu khác gần đây ghi nhận tỷ lệ sống sót chung là 86% khi thai nhi sinh sống và được chăm sóc sau sinh tích cực (36).
| CÁC ĐẶC ĐIỂM CHÍNH: Hội chứng không lá van động mạch phổi |
|
Được dịch từ sách: A practical Guide to Fetal Echocardiography: Normal and Abnormal Hearts 3E.
Người dịch: Bs Đặng Xuân Kỳ
Các bạn có thể tham khảo thêm các bất thường về siêu âm thai tại trang web: https://sieuamthai.xyz/
Mình không phải là chuyên gia về siêu âm tim thai nên bản dịch không tránh khỏi thiếu sót, mọi góp ý xin liên hệ Email mình: xuanky.dang@gmail.com.
Tài liệu tham khảo:
- Mitchell SC, Korones SB, Berendes HW. Congenital heart disease in 56,109 births. Incidence and natural history. Circulation. 1971;43:323–332.
2. Ferencz C. Epidemiology of Congenital Heart Disease: The Baltimore-Washington Infant Study, 1981–1989. Perspectives in Pediatric Cardiology. Mount Kisco, NY: Futura
Publishing; 1993.
3. Apitz B, Anderson RH, Redington A. Tetralogy of Fallot with pulmonary stenosis. In:
Anderson RH, ed. Pediatric Cardiology. 3rd ed. Philadelphia, PA: Elsevier; 2010:100–135.
4. Shinebourne EA, Babu-Narayan SV, Carvalho JS. Tetralogy of Fallot: from fetus to adult. Heart. 2006;92:1353–1359.
5. DeVore GR, Siassi B, Platt LD. Fetal echocardiography. VIII. Aortic root dilatation––a
marker for tetralogy of Fallot. Am J Obstet Gynecol. 1988;159:129–136.
6. Hornberger LK, Sanders SP, Sahn DJ, et al. In utero pulmonary artery and aortic growth and potential for progression of pulmonary outflow tract obstruction in tetralogy of Fallot. J Am Coll Cardiol. 1995;25:739–745.
7. Sinkovskaya E, Chaoui R, Karl K, et al. Fetal cardiac axis and congenital heart defects in early gestation: a multicenter study. Obstet Gynecol. 2015;125:453–460.
8. Poon LC, Huggon IC, Zidere V, et al. Tetralogy of Fallot in the fetus in the current era.
Ultrasound Obstet Gynecol. 2007;29:625–627.
9. Uretzky G, Puga FJ, Danielson GK, et al. Complete atrioventricular canal associated with tetralogy of Fallot. Morphologic and surgical considerations. J Thorac Cardiovasc Surg. 1984;87:756–766.
10. Rao BN, Anderson RC, Edwards JE. Anatomic variations in the tetralogy of Fallot. Am Heart J. 1971;81:361–371.
11. Need LR, Powell AJ, del Nido P, et al. Coronary echocardiography in tetralogy of Fallot: diagnostic accuracy, resource utilization and surgical implications over 13 years. J Am Coll Cardiol. 2000;36:1371–1377.
12. Boudjemline Y, Fermont L, Le Bidois J, et al. Prevalence of 22q11 deletion in fetuses with conotruncal cardiac defects: a 6-year prospective study. J Pediatr. 2001;138:520–524.
13. Goldmuntz E, Clark BJ, Mitchell LE, et al. Frequency of 22q11 deletions in patients with conotruncal defects. J Am Coll Cardiol. 1998;32:492–498.
14. Chaoui R, Heling KS, Lopez AS, et al. The thymic-thoracic ratio in fetal heart defects: a simple way to identify fetuses at high risk for microdeletion 22q11. Ultrasound Obstet
Gynecol. 2011;37:397–403.
15. Chaoui R, Kalache KD, Heling KS, et al. Absent or hypoplastic thymus on ultrasound: a marker for deletion 22q11.2 in fetal cardiac defects. Ultrasound Obstet Gynecol.
2002;20:546–552.
16. Besseau-Ayasse J, Violle-Poirsier C, Bazin A, et al. A French collaborative survey of
fetuses with 22q11.2 deletion: ultrasound findings, fetal autopsies and pregnancy outcomes. Prenat Diagn. 2014;34:424–430.
17. Corsten-Janssen N, Kerstjens-Frederikse WS, du Marchie Sarvaas GJ, et al. The cardiac phenotype in patients with a CHD7 mutation. Circ Cardiovasc Genet. 2013;6:248–254.
18. Pepas LP, Savis A, Jones A, et al. An echocardiographic study of tetralogy of Fallot in the fetus and infant. Cardiol Young. 2003;13:240–247.
19. Murphy JG, Gersh BJ, Mair DD, et al. Long-term outcome in patients undergoing surgical repair of tetralogy of Fallot. N Engl J Med. 1993;329:593–599.
20. Gibbs JL, Monro JL, Cunningham D, et al. Survival after surgery or therapeutic
catheterisation for congenital heart disease in children in the United Kingdom: analysis of the central cardiac audit database for 2000–1. Br Med J. 2004;328:611.
21. Quartermain MD, Glatz AC, Goldberg DJ, et al. Pulmonary outflow tract obstruction in fetuses with complex congenital heart disease: predicting the need for neonatal intervention. Ultrasound Obstet Gynecol. 2013;41:47–53.
22. Escribano D, Herraiz I, Granados M, et al. Tetralogy of Fallot: prediction of outcome in the mid-second trimester of pregnancy. Prenat Diagn. 2011;31:1126–1133.
23. Baker EJ, Anderson RH. Tetralogy of Fallot with pulmonary atresia. In: Anderson RH, Baker EJ, Redington A, et al, eds. Pediatric Cardiology. 3rd ed. Philadelphia, PA: Elsevier Health Care-Churchill-Livingstone; 2010:775–794.
24. Vesel S, Rollings S, Jones A, et al. Prenatally diagnosed pulmonary atresia with ventricular septal defect: echocardiography, genetics, associated anomalies and outcome. Heart. 2006;92:1501–1505.
25. Volpe P, Campobasso G, Stanziano A, et al. Novel application of 4D sonography with B-flow imaging and spatio-temporal image correlation (STIC) in the assessment of the anatomy of pulmonary arteries in fetuses with pulmonary atresia and ventricular septal defect. Ultrasound Obstet Gynecol. 2006;28:40–46.
26. Bharati S, Paul MH, Idriss FS, et al. The surgical anatomy of pulmonary atresia with
ventricular septal defect: pseudotruncus. J Thorac Cardiovasc Surg. 1975;69:713–721.
27. Momma K, Kondo C, Matsuoka R. Tetralogy of Fallot with pulmonary atresia associated with chromosome 22q11 deletion. J Am Coll Cardiol. 1996;27:198–202.
28. Chessa M, Butera G, Bonhoeffer P, et al. Relation of genotype 22q11 deletion to phenotype of pulmonary vessels in tetralogy of Fallot and pulmonary atresia-ventricular septal defect. Heart. 1998;79:186–190.
29. Digilio MC, Marino B, Grazioli S, et al. Comparison of occurrence of genetic syndromes in ventricular septal defect with pulmonic stenosis (classic tetralogy of Fallot) versus ventricular septal defect with pulmonic atresia. Am J Cardiol. 1996;77:1375–1376.
30. Kaguelidou F, Fermont L, Boudjemline Y, et al. Foetal echocardiographic assessment of tetralogy of Fallot and post-natal outcome. Eur Heart J. 2008;29:1432–1438.
31. Volpe P, Paladini D, Marasini M, et al. Common arterial trunk in the fetus: characteristics, associations, and outcome in a multicentre series of 23 cases. Heart. 2003;89:1437–1441.
32. Cho JM, Puga FJ, Danielson GK, et al. Early and long-term results of the surgical treatment of tetralogy of Fallot with pulmonary atresia, with or without major aortopulmonary collateral arteries. J Thorac Cardiovasc Surg. 2002;124:70–81.
33. Roche L, Greenway SC, Redington AN. Tetralogy of Fallot with pulmonary stenosis and tetralogy of Fallot with absent pulmonary valve. In: Allen HD, Driscoll DJ, Shaddy RE, et al, eds. Moss and Adams’ Heart Disease in Infants, Children, and Adolescents. 8th ed. Baltimore, MD: Williams & Wilkins; 2012:969–989.
34. Yeager SB, Van Der Velde ME, Waters BL, et al. Prenatal role of the ductus arteriosus in absent pulmonary valve syndrome. Echocardiography. 2002;19:489–493.
35. Allan LD, Sharland GK, Milburn A, et al. Prospective diagnosis of 1,006 consecutive cases of congenital heart disease in the fetus. J Am Coll Cardiol. 1994;23:1452–1458.
36. Wertaschnigg D, Jaeggi M, Chitayat D, et al. Prenatal diagnosis and outcome of absent pulmonary valve syndrome: contemporary single-center experience and review of the literature. Ultrasound Obstet Gynecol. 2013;41:162–167.
37. Philip S, Varghese M, Manohar K, et al. Absent pulmonary valve syndrome: prenatal cardiac ultrasound diagnosis with autopsy correlation. Eur J Echocardiogr. 2011;12:E44.
38. Favilli S, Lapi E, Pollini I, et al. Prenatal diagnosis and postnatal outcome in patients with absent pulmonary valve syndrome not associated with tetralogy of Fallot: report of one case and review of the literature. J Cardiovasc Med (Hagerstown) 2008;9:1127–1129.
39. Galindo A, Gutierrez-Larraya F, Martinez JM, et al. Prenatal diagnosis and outcome for fetuses with congenital absence of the pulmonary valve. Ultrasound Obstet Gynecol.
2006;28:32–39.
40. Volpe P, Paladini D, Marasini M, et al. Characteristics, associations and outcome of absent pulmonary valve syndrome in the fetus. Ultrasound Obstet Gynecol. 2004;24:623–628.
41. Razavi RS, Sharland GK, Simpson JM. Prenatal diagnosis by echocardiogram and outcome of absent pulmonary valve syndrome. Am J Cardiol. 2003;91:429–432.
42. Becker R, Schmitz L, Guschmann M, et al. Prenatal diagnosis of familial absent pulmonary valve syndrome: case report and review of the literature. Ultrasound Obstet Gynecol. 2001;17:263–267.
43. Berg C, Thomsen Y, Geipel A, et al. Reversed end-diastolic flow in the umbilical artery at 10–14 weeks of gestation is associated with absent pulmonary valve syndrome. Ultrasound Obstet Gynecol. 2007;30:254–258.
44. Moon-Grady AJ, Tacy TA, Brook MM, et al. Value of clinical and echocardiographic features in predicting outcome in the fetus, infant, and child with tetralogy of Fallot with absent pulmonary valve complex. Am J Cardiol. 2002;89:1280–1285.
45. Hu R, Zhang H, Xu Z, et al. Late outcomes for the surgical management of absent pulmonary valve syndrome in infants. Interact Cardiovasc Thorac Surg. 2
Để lại một phản hồi Hủy