Hầu hết các khối u ở thận được phát hiện tình cờ. Nhiều khối u trong số này là ung thư biểu mô tế bào thận (renal cell carcinomas). Mục tiêu của chẩn đoán hình ảnh là phân biệt ung thư biểu mô tế bào thận với bệnh lý lành tính, mặc dù trong nhiều trường hợp có thể khó phân biệt được.
Tuy nhiên, có một số dấu hiệu hình ảnh giúp gợi ý bệnh lý lành tính hoặc bệnh lý ác tính grade thấp. Các dấu hiệu hình ảnh này có thể cung cấp hướng dẫn cho bệnh nhân và bác sĩ giới thiệu (referring physicians) trong việc đưa ra quyết định điều trị. Các lựa chọn bao gồm cắt thận (nephrectomy) một phần hoặc triệt căn (radical), sinh thiết (biopsy) và đốt u (tumor ablation) hoặc theo dõi (follow-up) cẩn thận.
Trong bài viết này, chúng tôi sẽ thảo luận về các đặc điểm hình ảnh của khối u thận lành tính và ác tính và các tổn thương giống u thận.
Phân biệt các khối u thận (Differentiation of renal masses)
Các bước phân biệt tổn thương thận (renal lesion) gồm:
- Đầu tiên, xác định xem tổn thương có phải là nang (cyst) hay không.
- Nếu không phải là nang, hãy tìm mỡ đại thể (macroscopic fat), nghĩa là đó là u cơ mỡ mạch máu lành tính (angiomyolipoma-AML).
- Loại trừ (Exclude) các tổn thương giống khối u (tumor mimics) như nhiễm trùng (infection) và nhồi máu (infarction), thường xuất hiện trong các bối cảnh lâm sàng khác nhau.
- Loại trừ di căn (metastatic disease) và lymphoma; bệnh lý liên quan đến thận (kidney localizations) thường chỉ thấy trong bệnh lý lan tỏa (widespread disease).
Sau khi bạn đã thực hiện các bước này, sẽ có nhiều trường hợp không thể đưa ra chẩn đoán cuối cùng và ung thư biểu mô tế bào thận vẫn nằm đầu danh sách chẩn đoán phân biệt của bạn.
Sử dụng CT và MRI để tìm kiếm các dấu hiệu gợi ý khối u lành tính hoặc u ác tính grade thấp so với ung thư biểu mô tế bào thận grade cao.
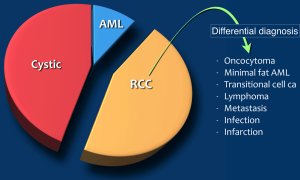
Chẩn đoán phân biệt của ung thư biểu mô tế bào thận (RCC):
– Oncocytoma: U tế bào hạt
– Minimal fat AML: U cơ mỡ mạch máu chứa ít mỡ
– Transitional cell carcinoma: Ung thư biểu mô tế bào chuyển tiếp
– Lymphoma
– Metastasis: di căn
– Infection: nhiễm trùng
– Infarction: nhồi máu.
Cắt lớp vi tính (CT scan)
Tăng đậm độ trên CT thì không tiêm thuốc tương phản (Hyperdensity on unenhanced CT)
– Tổn thương có đậm độ > 70 HU trên CT thì không tiêm thuốc tương phản là nang xuất huyết (hemorrhagic cyst).
– Nang xuất huyết có thể có đậm độ thấp hơn 70 HU, nhưng trong những trường hợp này, chúng ta cũng cần kiểm tra các hình ảnh sau khi tiêm thuốc tương phản để xem có bất kỳ sự bắt thuốc nào không.
– Việc không bắt thuốc tương phản giúp xác định tổn thương có bản chất là nang (cystic nature).
Mỡ đại thể (Macroscopic fat) < – 20 HU trong khối u thận là dấu hiệu đáng tin cậy của u cơ mỡ mạch máu (angiomyolipoma-AML).
Các lát cắt mỏng có thể hữu ích để xác định đậm độ (density).
Thật không may, 5% AML không chứa mỡ đại thể. Những AML nghèo mỡ (lipid-poor AMLs) này không thể phân biệt được với ung thư biểu mô tế bào thận (renal cell carcinoma-RCC).
Trong một số trường hợp hiếm gặp, RCC cũng có thể chứa mỡ. Sự hiện diện của vôi hóa và mỡ sẽ làm tăng nghi ngờ về RCC.
Bắt thuốc tương phản không rõ ràng (Equivocal enhancement) từ 10-20 HU có thể là do hiện tượng bắt thuốc giả (pseudo-enhancement) trong nang do hiện tượng cứng hóa chùm tia (beam hardening).
MRI có thể hữu ích trong việc phân biệt các trường hợp này, vì MRI giúp mô tả tốt hơn sự bắt thuốc tương phản. Sự bắt thuốc không rõ ràng cũng có thể được thấy trong các tổn thương bắt thuốc kém (low-enhancing lesions) như ung thư biểu mô tế bào thận dạng nhú (papillary renal cell carcinoma) thường là một phân nhóm ít tiến triển hơn so với ung thư biểu mô tế bào sáng (clear cell carcinoma) thường gặp hơn.
Bắt thuốc đồng nhất (Homogeneous enhancement) và giá trị đậm độ cao trên CT thì không tiêm thuốc (> 40 HU) gợi ý chẩn đoán AML nghèo mỡ, mặc dù không thể loại trừ RCC một cách chắc chắn.
Bắt thuốc mạnh (Strong enhancement) được thấy ở ung thư biểu mô tế bào sáng, AML nghèo mỡ và u tế bào hạt (oncocytoma).
Vì ung thư biểu mô tế bào sáng thường gặp hơn nhiều so với u tế bào hạt (oncocytoma) hoặc AML nghèo mỡ, nên ung thư biểu mô tế bào sáng là chẩn đoán có khả năng xảy ra nhất, đặc biệt là khối u có kích thước lớn và không đồng nhất (heterogeneous).
Cũng nên đề cập đến khả năng bị AML nghèo mỡ hoặc oncocytoma trong phần kết luận của bạn, vì theo dõi hoặc sinh thiết có thể là lựa chọn cho những bệnh nhân ít có khả năng phẫu thuật.
Diễn giải sơ đồ trên: Khối u ở thận trên CT:
- Không bắt thuốc: Nang
- Chứa mỡ đại thể: AML
- Bắt thuốc, không chứa mỡ: RCC hoặc khối u khác:
- Bắt thuốc không rõ (equivocal enhancement): 10-20 HU:
– Tổn thương bắt thuốc kém hoặc giả bắt thuốc: Xem xét chụp MRI
- Bắt thuốc nhẹ (mild enhancement):
– RCC (khả năng cao là dạng nhú), chẩn đoán phân biệt với: oncocytoma và AML nghèo mỡ:
+ Nếu bệnh nhân phẫu thuật được -> cắt bỏ (resection).
+ Nếu bệnh nhân không phẫu thuật được -> theo dõi hoặc sinh thiết để hướng dẫn điều trị.
- Bắt thuốc mạnh (vivid enhancement):
– RCC (khả năng cao là tế bào sáng), chẩn đoán phân biệt với: oncocytoma và AML nghèo mỡ:
+ Nếu bệnh nhân phẫu thuật được -> cắt bỏ (resection).
+ Nếu bệnh nhân không phẫu thuật được -> theo dõi hoặc sinh thiết để hướng dẫn điều trị.
Cộng hưởng từ (MRI)
Tín hiệu cao (High signal) trên xung T1W thường được thấy trong nang xuất huyết (hemorrhagic cysts) hoặc nang chứa dịch protein (proteinaceous cysts) và trong u cơ mỡ mạch máu (AML) có chứa mỡ ngoại bào đại thể (macroscopic extracellular fat).
Tuy nhiên, mỡ nội bào (Intracellular fat) không tạo ra tín hiệu cao trên xung T1W nhưng nó làm giảm tín hiệu (signal drop) trên xung out-of-phase. Điều này có thể thấy ở RCC hoặc AML nghèo mỡ.
82% RCC tế bào sáng chứa mỡ nội bào, có độ đặc hiệu 90% trong chẩn đoán ung thư biểu mô tế bào thận tế bào sáng.
MRI tốt hơn CT trong việc chẩn đoán chính xác tổn thương dạng nang (cystic lesion) và có thể mô tả tốt hơn sự bắt thuốc và giúp phân biệt hình ảnh giả bắt thuốc trên CT với hình ảnh bắt thuốc thật sự.
Tín hiệu thấp trên T2 gợi ý cho RCC dạng nhú (papillary RCC) hoặc AML nghèo mỡ.
Tín hiệu cao trên T2 thường được thấy ở RCC tế bào sáng (clear cell RCC) nhưng không đặc hiệu, vì nó cũng có thể thấy ở oncocytomas.
Vì vậy, một lần nữa có nhiều sự chồng lấp giữa khối u lành tính và ác tính
Diễn giải sơ đồ: Khối u ở thận trên MRI:
- DWI:
– Nang: tín hiệu thấp
– Áp xe, nhồi máu: tín hiệu cao
- Tín hiệu cao trên T1:
– AML: chứa mỡ đại thể
– Nang xuất huyết hoặc nang chứa dịch protein
- Xung out-of-phase: tín hiệu thấp
– Chứa mỡ nội bào: RCC hoặc AML
- Trên xung T2, có thể có tín hiệu cao, thấp hoặc đồng tín hiệu ở hầu hết các tổn thương bao gồm cả RCC.
Tổn thương dạng hình cầu (ball) hoặc hình hạt đậu (bean)
Một cách khác để đánh giá khối u đặc ở thận (renal solid masses) là xem hình dạng (shape).
Tổn thương đặc (Solid lesions) có thể được chia thành tổn thương dạng hình cầu (ball-type lesions) và tổn thương hình hạt đậu (bean-type lesions).
– Tổn thương dạng hình cầu (Ball-type lesions) là loại thường gặp nhất và biểu hiện dưới dạng khối u phát triển ra ngoài (expansile masses), làm biến dạng đường bờ của thận.
Ung thư biểu mô tế bào thận (Renal cell carcinomas) và oncocytoma là những tổn thương dạng hình cầu điển hình.
– Tổn thương dạng hình hạt đậu (Bean-type lesions) không làm biến dạng đường bờ của thận và hình dạng hạt đậu của thận được bảo tồn.
Tổn thương dạng hình hạt đậu khó phát hiện hơn và thường không nhìn thấy được trên CT thì không tiêm thuốc.
Lưu ý rằng có nhiều sự chồng lấp trong chẩn đoán phân biệt tổn thương dạng hình cầu và hình hạt đậu.
- Tổn thương dạng hình cầu (Ball-type lesion):
– Ung thư biểu mô tế bào thận (RCC)
– AML
– Oncocytoma
– Di căn
– Lymphoma
- Tổn thương dạng hình hạt đậu (Bean-type lesion):
– Ung thư biểu mô tế nào chuyển tiếp (TCC)
– RCC
– Lymphoma
– Di căn
– Nhiễm trùng (Infection)
– Nhồi máu (Infarction)
Tổn thương dạng hình hạt đậu (Bean-type lesions)
Các đặc điểm hình ảnh của tổn thương hình hạt đậu thường không đặc hiệu.
Chẩn đoán phân biệt thường có thể được gợi ý bằng cách kết hợp dữ liệu lâm sàng và hình ảnh.
– Một tổn thương thâm nhiễm trung tâm (central infiltrating lesion) lấp đầy bể thận (renal pelvis) ở bệnh nhân lớn tuổi rất có thể là ung thư biểu mô tế bào chuyển tiếp (transitional cell carcinoma-TCC), còn gọi là ung thư biểu mô tế bào niệu (urothelial cell carcinoma-UCC).
– Khối u dạng thâm nhiễm (infiltrative mass) ở bệnh nhân trẻ tuổi mang gen bệnh hồng cầu hình liềm (sickle cell trait) có khả năng là ung thư biểu mô tủy thận (renal medullary carcinoma).
– Tổn thương đa ổ và hai bên (Multifocal and bilateral lesions) hoặc thâm nhiễm lan tỏa thận kết hợp với bệnh lý hạch bạch huyết (lymphadenopathy) và liên quan đến các cơ quan khác gợi ý đến lymphoma.
– Tổn thương thận đa ổ và hai bên trong bệnh lý ác tính đã biết trước đó gợi ý di căn (metastases), mặc dù trong trường hợp chỉ có một khối u dạng thâm nhiễm, cần phải xem xét đến ung thư biểu mô tế bào thận dạng thâm nhiễm.
– Ở những bệnh nhân có đau (pain) và các dấu hiệu nhiễm trùng, chẩn đoán là viêm thận bể thận (pyelonephritis).
– Tổn thương dạng hình chêm gợi ý nhồi máu.
– TCC: ung thư biểu mô tế bào chuyển tiếp
– RCC – infiltrative: ung thư biểu mô tế bào thận dạng thâm nhiễm
– Lymphoma
– Metastasis: di căn
– Pyelonephritis: viêm thận bể thận
– Infarction: nhồi máu.
Kích thước của khối u (Size of a tumor)
Kích thước của khối u được coi là yếu tố dự đoán quan trọng nhất về tính ác tính và grade mô học tiến triển (aggressive histologic grade).
Nguy cơ của tổn thương là di căn phụ thuộc vào kích thước của khối u.
– Nếu kích thước của khối u nhỏ hơn 3 cm thì ít có khả năng là di căn.
– Hầu hết các khối u thận phát hiện tình cờ đều có kích thước nhỏ, được định nghĩa là < 4 cm. Nhiều khối u này có thể là RCC grade thấp, tổn thương ác tính phát triển chậm (indolent malignancies) hoặc tổn thương lành tính.
– Các khối u thận có kích thước 1-2 cm được cắt bỏ bằng phẫu thuật, 56% có mô học lành tính (benign histology). Chỉ có 13% khối u kích thước 6-7 cm có mô học lành tính.
Tuy nhiên, tốc độ phát triển của khối u nhỏ ở thận trên hình ảnh chụp liên tục để theo dõi vẫn chưa được chứng minh là có thể dự đoán đáng tin cậy về tính ác tính hay lành tính.
Nguy cơ tổn thương ở thận là di căn phụ thuộc vào kích thước của khối u.
Nếu kích thước của u < 3cm thì ít khả năng là di căn.
Ung thư biểu mô tế bào thận (Renal cell carcinoma)
Ung thư biểu mô tế bào thận (RCC) là tổn thương dạng hình cầu điển hình.
50% RCC là phát hiện tình cờ trên xét nghiệm hình ảnh được thực hiện cho các triệu chứng không phải ở đường tiết niệu.
Tỷ lệ mắc RCC cao nhất là từ 60 đến 70 tuổi.
RCC có liên quan đến các hội chứng di truyền (hereditary syndromes), như von Hippel-Lindau, xơ cứng củ (tuberous sclerosis) và Birt-Hogg-Dubé.
Phân nhóm (subtype) thường gặp nhất của RCC là ung thư biểu mô tế bào sáng (clear cell carcinoma), tiếp theo là RCC dạng nhú (papillary RCC) và RCC dạng kỵ màu (chromophobe RCC).
RCC dạng nang có nhiều khoang chứa dịch (Multilocular cystic RCC) hiếm gặp.
Ung thư biểu mô tủy thận (Renal medullary carcinoma) cũng rất ít gặp và hầu như chỉ xảy ra ở những bệnh nhân mang gen bệnh hồng cầu hình liềm.
Tổn thương dạng hình cầu phát triển lồi ra ngoài thận:
– RCC
– AML
– Oncocytoma
– Lymphoma
– Di căn
RCC tế bào sáng (Clear cell RCC)
Đây là phân nhóm thường gặp nhất của RCC, chiếm khoảng 70% tổng số RCC.
Khối u này phát sinh từ vỏ thận (renal cortex) và thường phát triển lồi ra ngoài (expansive). Đây là tổn thương tăng sinh mạch máu (hypervascular lesion), thường không đồng nhất do hoại tử (necrosis), xuất huyết (hemorrhage), thành phần dạng nang hoặc vôi hóa (calcifications).
Trong một số trường hợp hiếm gặp, RCC cũng có thể chứa mỡ ngoại bào. Trong khối u có cả vôi hóa và mỡ, hãy xem xét đến RCC.
Hình: RCC tế bào sáng thận phải.
Một đặc điểm điển hình của ung thư biểu mô tế bào sáng là tăng bắt thuốc mạnh (strong enhancement) ở thì vỏ tủy (corticomedullary phase). Đặc điểm này có thể khó đánh giá khi tổn thương có kích thước nhỏ và nằm ở vỏ thận, vì vỏ thận cũng tăng bắt thuốc mạnh.
Do đó, thì thận (nephrogenic phase) là thì dễ thấy nhất để phát hiện các tổn thương này vì nhu mô thận bắt thuốc đồng nhất và mạnh hơn khối u (hình bên dưới).
Hình: Ung thư biểu mô tế bào sáng được thấy rõ nhất ở thì thận (nephrogenic phase).
Trên MRI, RCC tế bào sáng thường đồng tín hiệu đến tín hiệu thấp trên T1 và tín hiệu cao (hyperintense) trên T2W.
Thông thường, RCC không chứa mỡ ngoại bào, điều này giúp phân biệt RCC với u cơ mỡ mạch máu (AML).
Tuy nhiên, 80% RCC tế bào sáng có mỡ nội bào (intracellular fat), dẫn đến giảm tín hiệu (drop in signal intensity) trên xung T1 opposed-phase (out-of-phase) so với xung in-phase.
Đừng nhầm lẫn dấu hiệu này với mỡ ngoại bào (extracellular fat) và không nên mắc sai lầm khi kết luận là AML.
Bệnh Von Hippel-Lindau liên quan đến sự phát triển của RCC tế bào sáng, thường là hai bên (bilateral) hoặc đa ổ (multifocal).
Bệnh nhân mắc RCC tế bào sáng có tỷ lệ sống còn sau 5 năm là 50-60%, thấp hơn RCC dạng nhú (papillary RCC) hoặc RCC dạng kỵ màu (chromophobe RCC).
Trong số tất cả các RCC tế bào sáng, khoảng 5% có kiểu phát triển dạng thâm nhiễm. Mặc dù dạng thâm nhiễm chỉ chiếm một phần nhỏ của RCC, nhưng tỷ lệ mắc bệnh chung của RCC làm điều này trở nên quan trọng để xem xét là chẩn đoán phân biệt của tổn thương hình hạt đậu dạng thâm nhiễm.
RCC dạng thâm nhiễm (Infiltrative RCCs) có tính tiến triển (aggressive) và tăng sinh mạch máu (hypervascular). Nó làm thay đổi cấu trúc bên trong của thận, bảo tồn đường bờ thận. Những bất thường của hệ thống thu thập nước tiểu (Collecting system abnormalities) có thể tương tự như những bất thường thấy ở ung thư biểu mô tế bào chuyển tiếp (TCC).
Hình: Tổn thương dạng thâm nhiễm ở cực trên (upper pole) của thận phải, hầu như không nhìn thấy trên hình ảnh thì không tiêm thuốc ở hình bên trái, nhìn thấy rõ ở thì thận được hiển thị ở hình bên phải. Giải phẫu bệnh (Pathological Anatomy) cho thấy là RCC tế bào sáng.
RCC dạng nhú (Papillary RCC)
RCC dạng nhú chiếm khoảng 10-15% trong tổng số RCC. Các tổn thương này thường đồng nhất (homogeneous) và ít tăng sinh mạch máu (hypovascular) và do đó có thể giống với nang.
Ngược với ung thư biểu mô tế bào sáng, sự bắt thuốc của ung thư biểu mô tế bào thận dạng nhú có thể rất kín đáo, chỉ chênh lệch 10-20 HU giữa hình ảnh ở thì không tiêm thuốc và thì có tiêm thuốc.
RCC dạng nhú có kích thước lớn hơn có thể không đồng nhất do hoại tử, xuất huyết hoặc vôi hóa.
Trên MRI, RCC dạng nhú thường đồng tín hiệu đến tín hiệu thấp trên T1 và tín hiệu thấp (hypointense) trên T2W.
Trong những trường hợp rất hiếm, có thể thấy mỡ đại thể trong tổn thương, thường kèm với vôi hóa.
Các khối u ở hai bên và đa ổ thường gặp hơn ở RCC dạng nhú so với các loại RCC khác. Tỷ lệ sống còn sau 5 năm là 80-90%.
Hình: RCC dạng nhú (Papillary RCC).
RCC dạng kỵ màu (Chromophobe RCC)
5% RCC là loại RCC kỵ màu.
Đây là tổn thương dạng đặc, có giới hạn rõ, bờ đều và đôi khi có bờ đa cung lớn. Chúng có thể có sẹo ở trung tâm (central scar) hoặc bắt thuốc tương phản kiểu bánh xe hình nan hoa (spoke-wheel pattern of contrast enhancement), tương tự như oncocytoma.
Không thể phân biệt RCC dạng kỵ màu với oncocytoma trên hình ảnh. Ngay cả mô học của những khối u này cũng có những đặc điểm tương tự nhau.
Sự bắt thuốc của RCC kỵ màu thường đồng nhất và bắt thuốc ít hơn so với RCC tế bào sáng.
Tiên lượng (prognosis) của RCC kỵ màu tương tự như tiên lượng của RCC dạng nhú với tỷ lệ sống còn sau 5 năm là 80-90%.
Hình: RCC dạng kỵ màu (Chromophobe RCC).
Có thể thấy RCC dạng kỵ màu (Chromophobe RCC) ở những bệnh nhân mắc hội chứng Birt-Hogg-Dubé. Hội chứng Birt-Hogg-Dubé là một rối loạn hiếm gặp.
Những bệnh nhân này có các tổn thương da dạng sẩn nhỏ gọi là u xơ nang lông (fibrofolliculomas), nang phổi (lung cysts) với tràn khí màng phổi tự phát (spontaneous pneumothorax) và tỷ lệ cao mắc các loại ung thư biểu mô tế bào thận khác nhau: thường gặp nhất là RCC dạng kỵ màu, ít gặp hơn là oncocytoma và hiếm khi là ung thư biểu mô tế bào sáng.
Hình: RCC dạng kỵ màu và nang ở phổi ở bệnh nhân mắc hội chứng Birt-Hogg-Dubé.
Phân giai đoạn của RCC (Staging RCC)
RCC có thể xâm lấn vào lớp mỡ quanh thận (perinephric fat) vượt ra ngoài mạc thận (renal fascia) và có thể lan vào tĩnh mạch thận, tĩnh mạch chủ dưới (IVC) hoặc tuyến thượng thận kế cận.
Đối với bác sĩ phẫu thuật, điều quan trọng là phải biết liệu có huyết khối do khối u (tumor thrombus) trong IVC hay không và liệu nó có lan vào vùng ngực phía trên cơ hoành hay không (cần có bác sĩ phẫu thuật lồng ngực trong quá trình phẫu thuật).
Khoảng 25% bệnh nhân có di căn khi phát hiện bệnh.
Phân giai đoạn RCC:
– Giai đoạn I: T1N0M0: T1 khi u kích thước < 7cm nằm trong thận.
– Giai đoạn II: T2N0M0: T2 khi u kích thước > 7cm nằm trong thận.
– Giai đoạn III: T3 hoặc bất kỳ T nào N1M0: T3 khi xâm lấn vào mô quanh thận nhưng không vượt ra ngoài mạc thận Gerota hoặc huyết khối do khối u ở tĩnh mạch.
– Giai đoạn IV: T4 hoặc M1: T4 khi u xâm lấn vào tuyến thượng thận cùng bên hoặc xâm lấn ra ngoài mạc Gerota.
Hình A: RCC giai đoạn T4: xâm lấn ra ngoài mạc quanh thận. Hạch di căn.
Hình B: RCC giai đoạn T4: Di căn tuyến thượng thận cùng bên.
Hình C: RCC giai đoạn T4: Huyết khối do khối u ở tĩnh mạch chủ dưới.
Hình: Huyết khối do khối u ở tĩnh mạch (Venous tumor thrombus)
MRI mặt cắt coronal cho thấy huyết khối do khối u lan vào tĩnh mạch chủ dưới phía trên cơ hoành (mũi tên). Cần có bác sĩ phẫu thuật lồng ngực trong quá trình phẫu thuật.
Di căn (Metastases)
25% bệnh nhân ung thư biểu mô tế bào thận có di căn khi phát hiện bệnh.
Các vị trí thường hay bị di căn là phổi, gan, hạch bạch huyết và xương.
Các vị trí ít phổ biến hơn là tụy, tuyến thượng thận, thận đối bên, mạc treo ruột, thành bụng và não.
Hình: Di căn của RCC ở tụy.
U cơ mỡ mạch máu (Angiomyolipoma)
U cơ mỡ mạch máu (AML) là khối u thận dạng đặc lành tính thường gặp nhất. U bao gồm mô mạch máu (angiomatous tissue), cơ trơn (smooth muscle) và mỡ.
Nếu tổn thương chứa mỡ đại thể trên CT, có thể chẩn đoán AML.
Trên CT, AML thường là khối u không đồng nhất, giới hạn rõ, nằm ở vỏ thận và chứa các vùng có đậm độ mỡ khoảng -20 HU hoặc thấp hơn.
Vôi hóa hoặc hoại tử bên trong khối u là rất hiếm.
Sự hiện diện của cả mỡ và vôi hóa sẽ làm tăng nghi ngờ về RCC.
Sự bắt thuốc tương phản được thấy ở các vùng có mạch máu và cơ trơn của tổn thương.
Hình: U cơ mỡ mạch máu (Angiomyolipoma).
Đa u cơ mỡ mạch máu (Multiple Angiomyolipomas)
AML rải rác thường có kích thước nhỏ, một bên và không có triệu chứng, thường được phát hiện tình cờ.
Trong 10-20% trường hợp, u cơ mỡ mạch máu là đa u và hai bên. Tình trạng này chủ yếu gặp ở những bệnh nhân bị xơ cứng củ (tuberous sclerosis).
Hình: Đa u cơ mỡ mạch máu của hai thận ở bệnh nhân bị xơ cứng củ.
Chảy máu trong AML (Bleeding in Angiomyopiloma)
Do các mạch máu bất thường (abnormal vessels) bên trong AML nên AML dễ bị chảy máu (bleeding).
Bệnh nhân có thể đau hông cấp (acute flank pain) do xuất huyết tự phát (spontaneous hemorrhage).
Nguy cơ xuất huyết tăng theo kích thước u.
Hình: Chảy máu trong AML (Bleeding in Angiomyopiloma).
Hình: Nút mạch (Embolization) được thực hiện để cầm máu.
Hình: Nút mạch phòng ngừa được khuyến cáo ở những khối u lớn hơn 4 cm, ngay cả ở những bệnh nhân không có triệu chứng.
Lưu ý các mạch máu lớn trong AML ở thận trái.
U cơ mỡ mạch máu nghèo mỡ (Minimal fat Angiomyolipoma)
Trong 5% AML không phát hiện được mỡ trên CT.
Mỡ có thể bị che lấp bởi xuất huyết bên trong u hoặc có thể là AML nghèo mỡ.
Trên MRI, mỡ đại thể trong AML cho tín hiệu thấp (low signal) trên xung xóa mỡ (fat-suppressed).
Mỡ vi thể hoặc mỡ nội bào, được thấy có giảm tín hiệu trên xung T1 opposed-phase so với xung in-phase, không đặc hiệu cho AML, nhưng cũng có thể có trong ung thư biểu mô tế bào thận (RCC).
Vì mỡ có khả năng nằm trong tế bào (mỡ nội bào) trong RCC, nên không có khả năng nhìn thấy trên hình ảnh CT.
U tế bào hạt (Oncocytoma)
Oncocytoma là khối u thận dạng đặc lành tính thường gặp thứ hai.
3-7% trong số tất cả các khối u thận dạng đặc là oncocytoma.
Oncocytoma biểu hiện dưới dạng tổn thương có giới hạn rõ, bờ đều với sự bắt thuốc đồng nhất (uniform enhancement) trên CT và thường có sẹo ở trung tâm (central scar).
Sẹo ở trung tâm không thể phân biệt được với sẹo trung tâm hoặc hoại tử trung tâm trong RCC, do đó oncocytoma là khối u dạng đặc lành tính thường được cắt bỏ nhất.
Hình: Oncocytoma ở thận trái với sẹo ở trung tâm.
Vôi hóa trong oncocytoma là rất hiếm.
Khối u thường đơn độc (solitary), đường kính 2-12 cm, nhưng có thể đa ổ (multifocal) và hai bên (bilateral).
Trong ít hơn 10% trường hợp, oncocytoma và RCC dạng kỵ màu có thể xảy ra đồng thời.
Hình: Oncocytoma ở thận phải có sẹo trung tâm.
H1: Trên CT.
H2: Xung T2 trên MRI
H3: Trên MRI: T1 có tiêm thuốc tương phản (T1Gd) – thì vỏ tủy (corticomedullary)
H4: Trên MRI: T1 có tiêm thuốc tương phản (T1Gd) – thì thận (nephrogenic).
Ung thư biểu mô tế bào chuyển tiếp (Transitional cell carcinoma)
Ung thư biểu mô tế bào chuyển tiếp (TCC) còn được gọi là ung thư biểu mô tế bào niệu (urothelial cell carcinoma-UCC) xuất phát từ các tế bào biểu mô (epithelial cells) lót đường tiết niệu.
– TCC thường xuất phát nhiều nhất ở bể thận (renal pelvis), dưới dạng khối u ở bề mặt (superficial tumor) grade thấp, tạo ra khối u nội ống khu trú trong hệ thống thu thập nước tiểu ở thận.
– Khoảng 15% TCC là loại tiến triển hơn với sự phát triển dạng thâm nhiễm, làm thay đổi cấu trúc vùng của xoang thận (renal sinus) và nhu mô thận kế cận, mà không làm thay đổi đường bờ thận (renal contour).
– TCC là tổn thương dạng hình hạt đậu điển hình (xem hình bên dưới).
TCC đường tiết niệu trên có tỷ lệ mắc bệnh cao nhất ở nhóm tuổi từ 60 đến 70 và thường gặp gấp đôi ở nam so với nữ.
Các yếu tố nguy cơ là hút thuốc lá, chất hóa học gây ung thư, liệu pháp cyclophosphamide và lạm dụng thuốc giảm đau (analgesic abuse), đặc biệt là sử dụng phenacetin trong thời gian dài.
Hình: TCC ở thận trái bảo tồn hình dạng hạt đậu của thận.
TCC khó phát hiện trên hình ảnh CT thì không tiêm thuốc (unenhanced CT).
– Thì thận (nephrogenic phase) là thì tốt nhất để thấy rõ ranh giới giữa TCC và nhu mô thận bắt thuốc tương phản bình thường.
– Hình ảnh thì bài tiết (Excretory phase) cho thấy các bất thường của hệ thống thu thập nước tiểu như đài thận giãn (dilated calyces), đài thận bị căng phồng (calyces distended) do khối u hoặc đài thận không được thấy rõ (unopacified calyces) do sự thâm nhiễm của khối u.
TCC có thể có tính chất tiến triển tại chỗ với sự xâm lấn vào khoang sau phúc mạc (retroperitoneum). Có thể thấy tình trạng hạch bạch huyết vùng (Regional lymphadenopathy) và di căn xa đến phổi và xương.
TCC thường là đa ổ với tỷ lệ tái phát cao, do đó cần phải theo dõi sát.
TCC có nguy cơ gieo rắc (seeding) sau sinh thiết qua da cao hơn RCC, do đó không nên thực hiện sinh thiết khi nghi ngờ TCC.
Hình: TCC ở thận phải bảo tồn hình hạt đậu của thận.
Lymphoma
Thận là vị trí ngoài hạch (extranodal site) phổ biến của lymphoma, đặc biệt là lymphoma không Hodgkin.
Lymphoma nguyên phát ở thận rất hiếm gặp.
Lymphoma ở thận thường biểu hiện dưới dạng nhiều khối u bắt thuốc kém, nhưng cũng có thể biểu hiện dưới dạng khối u sau phúc mạc (retroperitoneal tumors) xâm lấn trực tiếp vào thận hoặc dưới dạng khối u mô mềm quanh thận (perirenal soft-tissue masses).
Sự thâm nhiễm lan tỏa của mô kẽ thận làm cho thận to (nephromegaly) và thường gặp hơn ở lymphoma Burkitt.
Hình ảnh cho thấy lymphoma cả hai bên thận và tổn thương xương ở bệnh nhân bị lymphoma tế bào B.
Hình: Lymphoma tế bào B ở thận và xương (mũi tên).
Hình: Đây là một bệnh nhân khác bị lymphoma ở trung thất (mediastinum), tụy (pancreas) (mũi tên) và cả hai thận.
Hình: Hai thận to lan tỏa ở bệnh nhân bị lymphoma.
Tiếp tục với PET-CT ở bên dưới.
Hình: PET-CT cho thấy tình trạng tổn thương thận lan tỏa và hạch quanh động mạch chủ dương tính (mũi tên).
Di căn (Metastases)
Các khối u ác tính nguyên phát thường di căn đến thận là u phổi, vú, đường tiêu hóa và u hắc tố (melanom).
Di căn thận thường xảy ra ở giai đoạn muộn trong quá trình phát triển của khối u ác tính đã biết như một phần của tình trạng bệnh lan rộng.
Trong một số trường hợp hiếm gặp, di căn thận có thể biểu hiện dưới dạng một tổn thương đơn độc và có thể khó phân biệt với ung thư biểu mô tế bào thận. Có thể thực hiện sinh thiết qua da (percutaneous biopsy) để giúp phân biệt.
Hình: Tổn thương thâm nhiễm ở cực dưới của thận phải, tăng kích thước nhiều sau sáu tháng, với hạch bạch huyết lan rộng. Tình trạng này là do di căn của ung thư biểu mô phổi.
Di căn thận thường kích thước nhỏ, đa ổ và hai bên, với kiểu phát triển dạng thâm nhiễm. Với đặc điểm là bắt thuốc nhẹ, ít hơn nhiều so với nhu mô thận bình thường.
Tuy nhiên, di căn cũng có thể có tăng sinh mạch máu, như trong melanoma, và đôi khi là ung thư vú.
Hình ảnh bên dưới cho thấy một bệnh nhân có di căn thận đa ổ.
Lưu ý huyết khối của khối u ở tĩnh mạch thận trái.
Hình: Di căn gan và thận đa ổ. Huyết khối ở tĩnh mạch thận trái (mũi tên).
Hình: Đây là một bệnh nhân bị ung thư phổi. Có di căn ở thận trái và di căn nhiều hạch bạch huyết (mũi tên). Nếu chỉ có đặc điểm này, sẽ khó phân biệt với ung thư biểu mô tế bào thận có di căn hạch bạch huyết.
Nhiễm trùng (Infection)
Viêm thận bể thận (Pyelonephritis) và áp xe thận (renal abscess) có thể giống với khối u, nhưng trong hầu hết các trường hợp, tiền sử và các dấu hiệu lâm sàng giúp bạn đưa ra chẩn đoán đúng.
Trong trường hợp này, có các vùng giảm đậm độ ở cả hai thận.
Chỉ dựa trên hình ảnh, chẩn đoán phân biệt chính là viêm thận bể thận đa ổ, lymphoma và di căn.
Hình: Bệnh nhân này bị nhiễm trùng đường tiết niệu và đau hông từng cơn, không có tiền sử khối u nguyên phát hoặc lymphoma. Vì vậy, chẩn đoán là viêm thận bể thận.
Hình ảnh CT 4 tháng sau cho thấy sự bắt thuốc bình thường của cả hai thận; do đó, các bất thường ở thận trong lần chụp đầu tiên phù hợp với một đợt viêm thận bể thận đa ổ.
Hình: Áp xe thận thường là biến chứng (complication) của viêm thận bể thận cấp và bệnh nhân có biểu hiện nhiễm trùng đường tiết niệu, đau hông và sốt. Trên CT, áp xe thận thường biểu hiện dưới dạng tổn thương đậm độ thấp đồng nhất không đặc hiệu hoặc dưới dạng tổn thương dạng nang phức tạp.
Áp xe thận có thể có thành dày không đều tăng bắt thuốc kèm với thâm nhiễm mỡ quanh thận (hình dưới).
Ở những bệnh nhân có biểu hiện lâm sàng không điển hình, tổn thương kiểu dạng nang phức tạp và lan rộng vào mỡ quanh thận có thể giống với ung thư biểu mô tế bào thận.
Hình: Tổn thương dạng nang (Cystic lesion) có viền dày tăng bắt thuốc và thâm nhiễm mỡ quanh thận trái ở bệnh nhân bị áp xe thận.
Hình: Bệnh nhân này có biểu hiện điển hình với đau hông phải và các dấu hiệu xét nghiệm phù hợp với nhiễm trùng đường tiết niệu.
Hình ảnh siêu âm cho thấy tổn thương giảm âm (hypoechogenic lesion) với một số vùng trống âm (echolucency), cho thấy thành phần chứa dịch. Điều này đã được chứng minh là áp xe.
Viêm thận bể thận hạt vàng (Xanthogranulomatous pyelonephritis)
Viêm thận bể thận hạt vàng là tình trạng không thường gặp do nhiễm trùng hạt mạn tính (chronic granulomatous infection) với sự tích tụ của các đại thực bào chứa lipid (lipid-laden macrophages).
Thường có sỏi gây tắc nghẽn với sự giãn của các đài thận. Tình trạng này dẫn đến phá hủy thận lan tỏa, nhưng cũng có thể ở phân thùy thận (segmental).
Tất cả bệnh nhân đều có tình trạng thận to (Renal enlargement) và trong một số trường hợp có thể thấy mỡ đại thể.
Hình: Viêm thận bể thận hạt vàng (Xanthogranulomatous pyelonephritis) ở thận trái.
Hình: Trường hợp này là một ví dụ khác về viêm thận bể thận hạt vàng.
Có sự phá hủy thận phải, nhiều sỏi (calculi) và sự tăng sinh mô xơ và mô mỡ (fibrofatty proliferation) xung quanh. Đặc điểm này có thể giống với sarcoma mỡ (liposarcoma).
Nhồi máu thận (Renal infarction)
Nhồi máu thận (Renal infarction) thường do bệnh lý tim mạch gây huyết khối thuyên tắc mạch. Biểu hiện lâm sàng phổ biến là đau hông cấp và tiểu máu (hematuria).
Trong giai đoạn cấp, CT sẽ cho thấy một vùng hình chêm giảm đậm độ (decreased attenuation) sau đó thì vùng đó bị teo lại (atrophy) ở giai đoạn sau.
Khi toàn bộ thận bị nhồi máu, thận sẽ to ra và có đậm độ thấp (low attenuation). Chỉ có vỏ thận (cortex) ngoài cùng vẫn có thể tăng bắt thuốc nhờ tuần hoàn bàng hệ (collaterals) tạo ra dấu hiệu viền vỏ (cortical rim sign).
Hình: Nhồi máu thận (Renal infarction) trái.
Hình: Đây là một trường hợp khác của nhồi máu thận bên trái.
Hình: Nhồi máu ở thận phải và lách ở bệnh nhân có bệnh lý thuyên tắc mạch toàn thân nhiều vị trí.
Những cạm bẫy (Pitfalls)
Giả bắt thuốc tương phản (Pseudo-enhancement)
Giả bắt thuốc tương phản là một cạm bẫy cần lưu ý khi đánh giá khối u thận.
Như đã đề cập trước đó, có thể đo được sự khác biệt nhỏ về đơn vị Hounsfield (< 20 HU) trong nang thận trên hình ảnh CT có tiêm thuốc tương phản do hiện tượng cứng hóa chùm tia (beam-hardening).
Hình: Giả bắt thuốc trong nang thận.
Trường hợp này cho thấy giả bắt thuốc tương phản ở một tổn thương được chứng minh là nang trên MRI.
Bướu lạc đà (Dromedary hump)
Các cột Bertin hiện rõ, làm lồi (bulging) đường bờ của thận và phì đại (hypertrophy) thận khu trú có thể giống với khối u thận trên siêu âm không tiêm thuốc tương phản và CT thì thận (nephrogenic phase).
Ở thì vỏ tủy (corticomedullary phase), có thể thấy được hình ảnh vỏ tủy bình thường trong khối u giả này, giúp phân biệt phì đại cột Bertin với các tổn thương thực sự ở thận.
Hình: Bướu lạc đà (Dromedary hump)
Nghi ngờ có khối u thận ở thận trái trên siêu âm. CT cho thấy sự lồi ra của đường bờ thận trái, thường được gọi là bướu lạc đà (dromedary hump).
Hình: Khối u giả (Pseudotumor). Thì thận ở hình bên trái và thì vỏ tủy ở hình bên phải.
Đây là một trường hợp khác.
Trong thì thận, có thể thấy một tổn thương ở thận trái.
Tuy nhiên, trong thì vỏ tủy, rõ ràng đây là một khối u giả (pseudotumor).
Protocol của CT scan
CT là lựa chọn đầu tiên để mô tả đặc điểm của khối u thận và để phân giai đoạn.
Protocol chụp CT ít nhất phải bao gồm hình ảnh thì không tiêm thuốc và thì thận (nephrogenic phase).
Protocol chụp CT:
- Thì không tiêm thuốc (Unenhanced): Phát hiện mỡ, vôi hóa, dịch xuất huyết hoặc dịch protein.
- Thì vỏ tủy (Corticomedullary):
– Đánh giá sự tăng bắt thuốc của tổn thương tăng sinh mạch máu.
– Phân biệt với khối u giả.
- Thì thận (Nephrogenic): Phát hiện u, huyết khối (thrombus).
- Thì bài tiết (Excretory): Tùy chọn nếu cần chẩn đoán phân biệt với TCC.
– Thì vỏ tủy (corticomedullary phase) 25-40 giây sau khi tiêm thuốc được khuyến cáo mạnh. Thì này giúp phân biệt khối u với khối u giả và đánh giá sự bắt thuốc của tổn thương.
Tuy nhiên, trong thì này, khối u nằm trong vùng tủy thận (renal medulla) có thể có cùng đậm độ với nhu mô xung quanh (hình bên dưới).
– Do đó, thì thận (nephrogenic phase) (±100 giây sau khi tiêm thuốc) là thì quan trọng nhất để phát hiện khối u. Thì này cũng cung cấp thông tin về khả năng liên quan đến mạch máu và huyết khối do khối u (tumor thrombus).
– Thì bài tiết (excretory phase) (± 8 phút sau tiêm thuốc) là tùy chọn để thấy được hệ thống thu thập ở thận, niệu quản (ureters) và bàng quang (bladder). Không cần thiết chụp thì này để đánh giá khối u vỏ thận, nhưng nên thực hiện nếu cần chẩn đoán phân biệt với ung thư biểu mô tế bào chuyển tiếp (TCC).
Hình: Thì vỏ tủy (corticomedullary) và thì thận (nephrogenic).
Tài liệu tham khảo:
Người dịch: BS Lê Thị Ny Ny – Anhvanyds.
Để lại một phản hồi Hủy