Phình động mạch chủ ngực (Thoracic aortic aneurysms – TAAs) có thể được chia thành phình động mạch thật (true aneurysms) và phình động mạch giả (false aneurysms) (giả phình – pseudoaneurysms). Phình động mạch thật có cả ba lớp của thành động mạch chủ (lớp nội mạc, lớp trung mạc và lớp ngoại mạc), trong khi phình động mạch giả có ít hơn ba lớp của thành mạch và được bao bọc bởi lớp ngoại mạc (adventitia) hoặc các mô quanh lớp ngoại mạc (periadventitial tissues).
Chụp mạch máu cắt lớp vi tính đa dãy đầu dò (MDCT – Multidetector computed tomographic) cho phép đánh giá toàn diện phình động mạch chủ ngực (TAA) về các đặc điểm hình thái và mức độ, sự hiện diện của huyết khối (thrombus), sự liên quan đến các cấu trúc kế cận và các nhánh bên, dấu hiệu dọa vỡ hoặc vỡ cấp tính, và thường được sử dụng trong trường hợp này.
Kiến thức về nguyên nhân, tầm quan trọng, đặc điểm hình ảnh và các biến chứng tiềm ẩn của cả phình động mạch chủ thường gặp và ít gặp, cũng như đặc điểm hình ảnh bình thường sau phẫu thuật của động mạch chủ ngực, là điều cần thiết để chẩn đoán nhanh chóng và chính xác.
Giới thiệu
Phình động mạch (aneurysm) được định nghĩa là tình trạng giãn khu trú (focal dilatation) bất thường của mạch máu. Chụp mạch máu cắt lớp vi tính (CT) đa dãy đầu dò thường được thực hiện để chẩn đoán và đánh giá phình động mạch chủ ngực (thoracic aortic aneurysms – TAAs), về cơ bản đã thay thế chụp mạch chẩn đoán (diagnostic angiography).
Không giống như chụp mạch máu thông thường (conventional angiography), chỉ cho thấy lòng mạch của phình động mạch (lumen of an aneurysm), chụp CTA (CT angiography) còn cho thấy thành mạch và các thành phần bên trong lòng của phình động mạch, bao gồm huyết khối, do đó cho phép đo kích thước phình động mạch chính xác hơn và đánh giá các đặc điểm hình thái và các cấu trúc xung quanh. Trong bài viết này, chúng ta thảo luận và minh họa phình động mạch chủ ngực thường gặp và ít gặp, nhấn mạnh vào nguyên nhân, tầm quan trọng, các đặc điểm trên CT và các biến chứng tiềm ẩn của chúng.
Định nghĩa
Động mạch chủ ngực (thoracic aorta) bao gồm gốc (root) động mạch chủ, động mạch chủ lên (ascending aorta), quai động mạch chủ (aortic arch) và động mạch chủ ngực xuống (descending thoracic aorta) (Hình 1). Động mạch chủ lên kéo dài từ gốc đến vị trí xuất phát của động mạch thân cánh tay đầu phải (right brachiocephalic artery); quai động mạch từ động mạch thân cánh tay đầu bên phải đến vị trí bám của dây chằng động mạch (ligamentum arteriosum); và động mạch chủ xuống, từ dây chằng động mạch đến lỗ động mạch chủ ở cơ hoành.
Gốc động mạch chủ được định nghĩa là một phần của động mạch chủ lên chứa các lá van, vòng van và xoang Valsalva. Quai động mạch chủ có thể được chia thành các đoạn gần (động mạch thân đầu cánh tay bên phải đến động mạch dưới đòn bên trái) và đoạn xa (động mạch dưới đòn bên trái đến chỗ bám của dây chằng động mạch). Đoạn xa của quai động mạch chủ còn được gọi là eo (isthmus) động mạch chủ, có thể có đường kính nhỏ hơn động mạch chủ xuống đoạn gần.
Phình động mạch chủ ngực (TAA) được định nghĩa là tình trạng giãn bất thường dai dẳng của động mạch chủ ngực. Mặc dù đường kính động mạch chủ tăng nhẹ theo tuổi, đường kính bình thường của động mạch chủ lên đoạn giữa (midascending aorta) phải luôn nhỏ hơn 4 cm và động mạch chủ xuống không quá 3 cm.
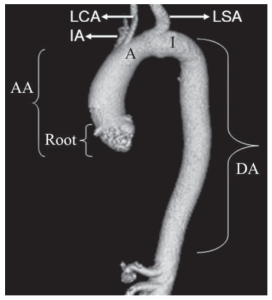
Hình 1. Hình ảnh tái tạo thể tích (VR – volume-rendered) 3D cho thấy các đoạn giải phẫu của động mạch chủ ngực. A = quai (arch), AA = động mạch chủ lên (ascending aorta), DA = động mạch chủ xuống (descending aorta), I = eo (isthmus), IA = động mạch vô danh (innominate artery) (động mạch thân cánh tay đầu – brachiocephalic trunk), LCA = động mạch cảnh chung trái (left common carotid artery), LSA = động mạch dưới đòn trái (left subclavian artery).
Nguyên nhân
Xơ vữa động mạch (Atherosclerosis) là nguyên nhân gây ra khoảng 70% phình động mạch chủ ngực (TAA) (Hình 2); hầu hết phình động mạch chủ ngực (TAA) do xơ vữa động mạch xảy ra ở động mạch chủ ngực xuống. Vì phình động mạch chủ bụng (abdominal aortic aneurysm) xảy ra ở 28% bệnh nhân bị phình động mạch chủ ngực (TAA), nên điều quan trọng là đánh giá ban đầu phải bao gồm toàn bộ động mạch chủ ngực bụng.
Nguyên nhân gây ra phình động mạch chủ ngực (TAA) được liệt kê trong Bảng 1. Tỷ lệ bị phình động mạch chủ ngực (TAA) được báo cáo thay đổi tùy theo nguyên nhân. Ngoài ra, việc phân loại chính xác phình động mạch theo nguyên nhân có thể khó khăn, vì không thể xác định chính xác nguyên nhân một cách chắc chắn trong mọi trường hợp. Trong một nghiên cứu về 51 trường hợp bị phình động mạch chủ ngực (TAA) với tương quan bệnh học, nguyên nhân được xác định là do bóc tách động mạch chủ (aortic dissection) ở 53% trường hợp, xơ vữa động mạch (atherosclerosis) ở 29%, viêm động mạch chủ (aortitis) ở 8%, hoại tử lớp trung mạc dạng nang (cystic medial necrosis) ở 6% và giang mai (syphilis) ở 4%.
|
Bảng 1: Nguyên nhân phình động mạch chủ ngực |
| – Xơ vữa động mạch
– Bóc tách động mạch chủ – Thoái hóa lớp trung mạc (di truyền) – Hội chứng Marfan – Hội chứng Ehlers-Danlos – Tác động bên ngoài (mắc phải) – Chấn thương – Bệnh giang mai – Bệnh nấm (nhiễm trùng) – Viêm động mạch chủ không do nhiễm trùng – Thấp tim (Rheumatic fever) – Viêm khớp dạng thấp (Rheumatoid arthritis) – Viêm cột sống dính khớp (Ankylosing spondylitis) – Viêm động mạch tế bào khổng lồ (Giant cell arteritis) – Viêm đa sụn tái phát (Relapsing polychondritis) – Viêm động mạch Takayasu – Hội chứng Reiter – Lupus ban đỏ hệ thống (Systemic lupus erythematosus) – Xơ cứng bì (Scleroderma) – Bệnh vảy nến (Psoriasis) – Viêm loét đại tràng (Ulcerative colitis) – Xạ trị (Radiation) – Bệnh Behçet – Phình động mạch bẩm sinh (hiếm gặp) |
Hình 2. Phình động mạch chủ ngực (TAA) xuống dạng hình thoi ở bệnh nhân nam 80 tuổi. (a) Chụp CT có tiêm thuốc tương phản cho thấy phình động mạch chứa huyết khối (mũi tên). (b) Hình ảnh tái tạo thể tích (VR) 3D cho thấy mức độ tổng thể của thay đổi xơ vữa động mạch, chủ yếu ở động mạch chủ ngực xuống và các nhánh của quai động mạch chủ.
Giãn gốc động mạch chủ (Annuloaortic ectasia), một tình trạng đặc trưng bởi các xoang Valsalva giãn ra làm mất ranh giới (effacement) chỗ nối xoang ống (sinotubular junction) của gốc động mạch chủ và động mạch chủ lên tạo ra động mạch chủ hình quả lê (a pear-shaped aorta) thuôn dần thành quai động mạch chủ bình thường, thường liên quan nhất đến hội chứng Marfan (Hình 3). Các nguyên nhân khác bao gồm homocystin niệu (homocystinuria), hội chứng Ehlers-Danlos và bệnh xương thủy tinh (osteogenesis imperfecta); tuy nhiên, giãn gốc động mạch chủ (Annuloaortic ectasia) có thể là vô căn (idiopathic) ở khoảng 1/3 trường hợp.
Mặc dù hình ảnh động mạch chủ ở bệnh nhân mắc hội chứng Marfan giống với bệnh nhân bị thoái hóa lớp trung mạc vô căn (idiopathic medial degeneration), nhưng có sự khác biệt đáng kể trong diễn biến tự nhiên của hai tình trạng này, với sự khởi phát và tiến triển đều nhanh hơn ở hội chứng Marfan.
Hình 3. Hội chứng Marfan và giãn gốc động mạch chủ (annuloaortic ectasia) ở bệnh nhân nam 40 tuổi. Chụp CT có tiêm thuốc tương phản (a) và hình ảnh tái tạo thể tích (VR) ba chiều (b) cho thấy động mạch chủ hình quả lê thuôn dần về quai động mạch chủ bình thường, một đặc điểm hình ảnh của hội chứng Marfan và giãn gốc động mạch chủ.
Phình động mạch do giang mai (syphilis) hiện nay rất hiếm, với phương pháp điều trị hiệu quả cho bệnh lý truyền nhiễm này. Bệnh lý tim mạch đã được báo cáo ở 12% bệnh nhân bị giang mai không được điều trị, thường có thời kỳ ủ bệnh (latency period) là 10–30 năm sau khi nhiễm trùng ban đầu. Viêm động mạch chủ do giang mai (Syphilitic aortitis) gây phá hủy khu trú lớp trung mạc với mất các sợi cơ đàn hồi và cơ trơn cũng như để lại sẹo, dẫn đến giãn động mạch chủ (aortic dilatation) và phình động mạch (aneurysms). Vị trí thường gặp nhất của phình động mạch chủ ngực (TAA) này là động mạch chủ ngực lên (36% trường hợp), tiếp theo là quai động mạch chủ (34%), động mạch chủ ngực xuống đoạn gần (25%) và động mạch chủ ngực xuống đoạn xa (5%).
Xoang động mạch chủ (Aortic sinus) bị ảnh hưởng xảy ra < 1% các trường hợp và thường không đối xứng (asymmetric), trái ngược với tình trạng giãn ra đối xứng được thấy trong giãn gốc động mạch chủ (annuloaortic ectasia). Một biểu hiện ít gặp hơn của viêm động mạch chủ do giang mai là hẹp lỗ động mạch vành do sẹo dưới lớp nội mạc, dẫn đến thiếu máu cục bộ cơ tim (myocardial ischemia); tình trạng này có tiên lượng xấu, với thời gian sống trung bình chỉ 6–8 tháng kể từ khi xuất hiện các triệu chứng của tim. Phình động mạch do giang mai có nguy cơ vỡ cao, với tử vong do vỡ động mạch chủ được báo cáo ở 40% các trường hợp. Bóc tách ít gặp hơn do có sẹo ở lớp trung mạc.
Sự hiện diện của van động mạch chủ hai mảnh (bicuspid aortic valve) là một yếu tố nguy cơ độc lập đối với sự hình thành phình động mạch chủ ngực (TAA) (Hình 4), và không chỉ đơn thuần là hậu quả của tình trạng giãn ra sau hẹp thứ phát do hẹp động mạch chủ. Mặc dù hẹp động mạch chủ (aortic stenosis) là biến chứng thường gặp của van động mạch chủ hai mảnh vì các van bị rối loạn chức năng dễ bị xơ hóa sớm và lắng đọng canxi, nhưng phình động mạch chủ liên quan đến van động mạch chủ hai mảnh không phải là thứ phát do rối loạn chức năng van và đã được mô tả khi không có hẹp động mạch chủ và suy van động mạch chủ đáng kể, cũng như ở những bệnh nhân đã trải qua phẫu thuật thay van nhân tạo thành công cho van động mạch chủ hai mảnh.
Hình 4. Phình động mạch chủ lên và van động mạch chủ hai mảnh ở bệnh nhân nữ 40 tuổi. (a, b) Chụp CT có tiêm thuốc tương phản (a) và hình ảnh tái tạo thể tích (VR) (b) cho thấy phình động mạch chủ lên. (c) Hình ảnh mặt phẳng axial chếch qua mặt phẳng của van động mạch chủ cho thấy bản chất hai mảnh của van động mạch chủ.
Viêm động mạch chủ có thể là do nhiễm trùng hoặc không do nhiễm trùng. Nhiễm trùng không do giang mai ở thành động mạch với tình trạng giãn phình động mạch (aneurysmal dilatation) được gọi là phình động mạch hình dạng giống cây nấm (mycotic aneurysm). Mặc dù lớp nội mạc có khả năng chống lại nhiễm trùng cực kỳ cao, nhưng bất kỳ tình trạng nào gây tổn thương thành động mạch chủ đều khiến bệnh nhân dễ bị phình động mạch hình dạng giống cây nấm (mycotic aneurysm), bao gồm viêm nội tâm mạc do vi khuẩn từ cấu trúc lân cận (contiguous bacterial endocarditis), xơ vữa động mạch, lạm dụng thuốc và chấn thương động mạch chủ.
Bệnh nhân suy giảm miễn dịch cũng có tỷ lệ phình động mạch hình dạng giống cây nấm (mycotic aneurysms) tăng cao. Phình động mạch hình dạng giống cây nấm (mycotic aneurysms) thường có dạng túi (saccular) và chứa huyết khối lệch tâm (eccentric thrombus) (Hình 5). Tổn thương có xu hướng liên quan đến động mạch chủ lên, nằm gần các vùng bị ảnh hưởng do viêm nội tâm mạc. Các tác nhân gây nhiễm trùng thường gặp nhất là Streptococcus không tan máu, Pneumococcus, Staphylococcus, Gonococcus và các loài Salmonella. Bệnh lao (Tuberculosis) có thể liên quan đến động mạch chủ bằng cách lây lan từ hạch bạch huyết và cột sống lân cận.
Hình 5. Chụp CT có tiêm thuốc tương phản ở bệnh nhân nam 50 tuổi cho thấy áp xe trung thất sau thực quản (retroesophageal mediastinal abscess) và giả phình động mạch dạng cây nấm (mycotic pseudoaneurysm) của động mạch chủ ngực xuống (mũi tên).
Một số nguyên nhân gây viêm động mạch chủ không nhiễm trùng có thể dẫn đến phình động mạch. Viêm động mạch chủ thường ảnh hưởng nhất đến động mạch chủ lên trong viêm khớp dạng thấp (rheumatoid arthritis), viêm cột sống dính khớp (ankylosing spondylitis), viêm động mạch tế bào khổng lồ (giant cell arteritis) và viêm đa sụn tái phát (relapsing polychondritis). Những tình trạng này cũng có thể liên quan đến suy van động mạch chủ (aortic valve insufficiency). Viêm động mạch chủ là một đặc điểm hiếm gặp của bệnh thấp tim (rheumatic fever) và có thể theo từng đoạn, giới hạn ở động mạch chủ lên, liên quan đến động mạch chủ bụng hoặc liên quan đến toàn bộ động mạch chủ.
Viêm động mạch Takayasu, một tình trạng viêm mạch máu thường gặp ở phụ nữ Châu Á, thường ảnh hưởng đến quai động mạch chủ và các nhánh chính của nó, với sự liên quan khác nhau của động mạch chủ bụng và động mạch phổi. Mặc dù viêm động mạch Takayasu thường gây hẹp (stenosis) và tắc (occlusion) động mạch, phình động mạch cũng có thể xảy ra (Hình 6). Các đặc điểm CT bao gồm thành động mạch chủ dày lên có đậm độ cao kèm vôi hóa trên CT thì không tiêm thuốc tương phản. Sự tăng bắt thuốc động mạch (Arterial enhancement) được xem là dấu hiệu của bệnh đang hoạt động.
Hình 6. Viêm động mạch Takayasu (Takayasu arteritis) ở bệnh nhân nữ 35 tuổi. (a, b) Chụp CT có tiêm thuốc tương phản thu được ở ngang mức động mạch chủ lên (a) và động mạch chủ xuống đoạn xa (b) cho thấy dày thành động mạch chủ lan tỏa và phình động mạch chủ lên. (c) Hình ảnh tái tạo thể tích (VR) cho thấy nhiều vị trí hẹp và hình thành phình động mạch liên quan đến động mạch chủ và các nhánh của nó.
Phình động mạch sau chấn thương (Posttraumatic aneurysms) do chấn thương kín (blunt trauma) có thể là kết quả của sự giảm tốc độ nhanh chóng (rapid deceleration), một cơ chế tổn thương được công nhận rộng rãi. Theo lý thuyết này, đoạn xa nằm ngang của quai động mạch chủ di chuyển về phía trước trong khi đoạn gần của động mạch chủ ngực xuống vẫn cố định, được giữ lại bởi dây chằng động mạch và các mạch máu liên sườn. Một cơ chế được đề xuất khác là “sự kẹp chặt động mạch giữa các cấu trúc xương – osseous pinch”, trong đó lực nén ép trước sau dẫn đến sự dịch chuyển ra sau dưới của cán xương ức (manubrium), xương sườn thứ nhất và đầu trong của xương đòn, đè lên động mạch chủ và chèn ép động mạch chủ vào cột sống ngực ở phía sau. Vị trí tổn thương thường thấy nhất ở những bệnh nhân bị chấn thương còn sống sót đến được bệnh viện là eo động mạch chủ (90% trường hợp), tiếp theo là động mạch chủ lên và động mạch chủ xuống gần lỗ chui qua cơ hoành.
Giả phình động mạch mạn tính (Chronic pseudoaneurysms) xuất hiện ở 2.5% bệnh nhân sống sót sau chấn thương ban đầu. Giả phình động mạch này thường vôi hóa, có thể chứa huyết khối (Hình 7) và có khả năng giãn ra dần, thậm chí vỡ sau nhiều năm bị chấn thương ban đầu.
Bóc tách động mạch chủ (Aortic dissection) là hiện tượng máu đi vào lớp trung mạc thông qua vết rách lớp nội mạc một cách bất thường. Điều này tạo ra lòng giả (false lumen) được tách khỏi lòng thật (true lumen) bằng một lá nội mạc (intimal flap). Bóc tách động mạch chủ trước đó với sự tưới máu lòng giả dai dẳng có thể gây ra giãn phình động mạch ở lòng giả. Phình lòng giả này chỉ được bao bọc bởi lớp trung mạc ngoài cùng và lớp ngoại mạc và có xu hướng giãn ra theo thời gian (Hình 8).
Hình 7. Chụp CT có tiêm thuốc tương phản ở bệnh nhân nam 28 tuổi cho thấy giả phình động mạch dạng túi sau chấn thương (posttraumatic saccular pseudoaneurysm) ở eo động mạch chủ (ortic isthmus) (mũi tên).
Hình 8. Hình ảnh CT mặt phẳng axial (a) và hình ảnh CT tái tạo mặt phẳng sagittal chếch (b) có tiêm thuốc tương phản thu được ở bệnh nhân nam 65 tuổi cho thấy tình trạng bóc tách động mạch chủ type B với lòng giả có huyết khối một phần và phình động mạch chủ ngực xuống.
Kỹ thuật chụp CT
Khi nghi ngờ hội chứng động mạch chủ cấp (do các dấu hiệu và triệu chứng lâm sàng hoặc đặc điểm trên phim chụp X-quang ngực), CT không tiêm thuốc tương phản thường được thực hiện đầu tiên để tìm tụ máu trong thành (intramural hematoma) cấp tính có đậm độ cao. Chụp CT có tiêm thuốc tương phản sau đó là quá trình chính của việc kiểm tra CT. Thời điểm chính xác của thuốc tương phản đến động mạch chủ là rất quan trọng đối với chất lượng hình ảnh. Các phương pháp tiếp cận để thực hiện điều này bao gồm kỹ thuật bolus theo thời gian (timing bolus) hoặc bolus tracking.
Cổng điện tâm đồ (ECG) thường được sử dụng để giảm hiện tượng xảo ảnh do chuyển động (motion artifacts), có thể giống với bóc tách hoặc các bất thường trong lòng động mạch; điều này đặc biệt quan trọng với nhịp tim cao hơn và ở những vị trí chuyển động nhiều nhất theo chuyển động của tim, như động mạch chủ lên. Ngoài ra, cổng ECG (ECG gating) có thể tạo điều kiện thuận lợi cho việc đánh giá ít nhất các động mạch vành đoạn gần (nếu không phải toàn bộ hệ thống động mạch vành) nếu các thông số thu thập được chỉ định cung cấp độ phân giải không gian và thời gian thích hợp. Trong trường hợp nghi ngờ bóc tách động mạch chủ, cổng ECG có thể hữu ích để xác định sự liên quan với động mạch vành. Chúng tôi thường sử dụng cổng ECG cho phần ngực khi chụp CT của động mạch chủ, được thực hiện trên máy chụp CT 16 hoặc 64 đầu dò.
Roos và cộng sự đã so sánh các lần chụp CT có gắn cổng ECG với không gắn cổng ECG của động mạch chủ ngực và thấy rằng có sự giảm đáng kể hiện tượng xảo ảnh do chuyển động khi sử dụng cổng ECG. Mặc dù hiện tượng xảo ảnh do chuyển động giảm khi khoảng cách từ tim tăng lên, các tác giả thấy rằng có sự giảm đáng kể hiện tượng xảo ảnh do chuyển động cho toàn bộ động mạch chủ ngực. Tuy nhiên, lợi ích tối đa được thấy ở ngang mức van động mạch chủ và động mạch chủ lên. Chúng tôi thực hiện chụp CT theo hướng từ đầu xuống dưới (craniocaudal), và cổng ECG được tắt ở ngang mức cơ hoành, giúp giảm thời gian nín thở và liều tia xạ.
Trước đây, cổng ECG chủ yếu là cổng được hồi cứu lại, với dữ liệu được thu thập trong toàn bộ chu kỳ tim. Điều này cho phép đánh giá các đặc điểm hình thái van động mạch chủ trên hình ảnh tĩnh ở cuối kỳ tâm thu và cuối kỳ tâm trương, đo diện tích bề mặt van động mạch chủ (Hình 9) và xem chuyển động của lá van ở chế độ cine. Sự gắn kết không hoàn toàn của các lá van tương ứng với tình trạng hở van (regurgitation), và sự mở van hạn chế tương ứng với tình trạng hẹp van (stenosis). Ví dụ, phình động mạch chủ lên có thể liên quan đến van động mạch chủ hai mảnh phát hiện tình cờ hoặc hẹp van động mạch chủ vôi hóa.
Tuy nhiên, chụp CT có cổng ECG được hồi cứu lại có liên quan đến liều tia xạ cao hơn so với chụp CT không có cổng ECG. Trong nghiên cứu của Roos và cộng sự, liều tia xạ với chụp CT có cổng ECG được hồi cứu lại và không có cổng ECG của động mạch chủ ngực lần lượt là 8.85 và 4.5 mSv. Phạm vi bao phủ khi chụp CT từ đầu đến chân là 15 cm, với điện thế ống (tube potential) là 120 kVp, độ chuẩn trực (collimation) là 1 mm và chiều rộng lát cắt là 1.25 mm. Dòng điện và pitch của ống được sử dụng cho chụp CT có cổng ECG và không có cổng lần lượt là 140 mAs/1.5 và 250–400 mAs/0.38–0.75. Điều chỉnh dòng điện của ống, với việc giảm đầu ra (output) của ống trong thời kỳ tâm thu, có thể giảm liều tia xạ liên quan đến việc chụp CT có cổng ECG được hồi cứu lại và thường được sử dụng tại bệnh viện của chúng tôi. Giảm liều trung bình 48% đối với nam giới và 45% đối với nữ giới đã được báo cáo với kỹ thuật này. Ngoài ra, kỹ thuật kích hoạt triển vọng mới hơn chỉ thu thập dữ liệu CT tại một điểm hoặc cụm điểm cụ thể trong chu kỳ tim, giảm thời gian chiếu tia CT xuống một phần nhỏ so với thời gian chụp có cổng ECG hồi cứu, do đó giảm đáng kể liều tia xạ.
Giảm liều tia xạ trung bình ở bệnh nhân đã được chứng minh là 77%–83% đối với chụp CT động mạch vành có gắn cổng ECG tiến cứu (prospectively gated) so với chụp động mạch vành có gắn cổng ECG hồi cứu lại (retrospectively gated) (có điều chỉnh dòng điện của ống) được thực hiện trên máy chụp CT 64 đầu dò.
Hình 9. Hẹp van động mạch chủ ở bệnh nhân nữ 74 tuổi. Trên hình CT mặt phẳng axial chếch qua các lá van động mạch chủ (aortic valve leaflets) thu được vào cuối thời kỳ tâm thu, diện tích bề mặt van động mạch chủ đo được là 0.9 cm².
Khi đánh giá động mạch chủ ngực để can thiệp sửa chữa nội mạch, phạm vi bao phủ từ đầu đến chân (craniocaudal coverage) nên mở rộng từ vùng cổ (neck) đến chỏm xương đùi. Đánh giá khả năng tiếp cận động mạch đùi chung (common femoral artery) là điều cần thiết để xác định tính khả thi của việc tiếp cận bằng ống thông có kích thước lớn (large-bore sheath access).
Cần phải nắm rõ về mối liên hệ giữa phình động mạch chủ và các nhánh của động mạch chủ để đánh giá mức độ phù hợp của “vùng neo của stent – landing zone” (các đoạn gần và đoạn xa của động mạch chủ tổn thương nơi sẽ đặt đầu gần và đầu xa của stent).
Để đảm bảo cổ của động mạch chủ thích hợp cho đầu gần và đầu xa của stent neo lại tốt, các có các điều kiện sau:
+ (a) khoảng cách tối thiểu là 15 mm từ vị trí phình động mạch đến động mạch dưới đòn trái và đến động mạch thân tạng
+ (b) đường kính vùng neo lại stent (landing zone) của động mạch chủ tối đa là 40 mm và,
+ (c) không có huyết khối (thrombus) hoặc mảng xơ vữa (atheroma) theo chu vi trong vùng neo lại của stent (landing zone).
Nếu tổn thương nằm rất gần với động mạch dưới đòn trái, có thể cần phải che phủ vị trí xuất phát động mạch dưới đòn để đảm bảo vùng neo stent thích hợp; tuy nhiên, phải chứng minh được sự thông suốt (patency) của cả hai động mạch đốt sống trước khi tiến hành thủ thuật. Để đánh giá việc sửa chữa bằng stent graft trong phình động mạch chủ, điều quan trọng là phải đánh giá endoleak (rò rỉ) trên thì chụp muộn. Chúng tôi thường chụp thì muộn này 60 giây sau khi chụp thì động mạch.
Xử lý dữ liệu CT (CT Data Manipulation)
CT là phương thức chính để đánh giá các bất thường của động mạch chủ ngực. CT đa dãy đầu dò, với khả năng tái tạo đa mặt phẳng, có thể được sử dụng để đánh giá phình động mạch ở bất kỳ mặt phẳng nào, xác định kích thước và các đặc điểm hình thái, làm rõ mối liên quan của phình động mạch với các nhánh mạch máu, đánh giá tác động của phình động mạch lên các cấu trúc lân cận và xác định các biến chứng như bóc tách và vỡ.
Các lựa chọn (options) này mang lại cho CT đa dãy đầu dò một lợi thế rõ ràng so với chụp động mạch thông thường, cung cấp thông tin chủ yếu của lòng động mạch chủ. Trong một loạt các trường hợp chụp CT bao gồm 33 trường hợp phình động mạch ngực, 3 trường hợp vỡ phình động mạch chủ ngực, 6 trường hợp loét mảng xơ vữa xuyên thành (PAU), 5 trường hợp bóc tách động mạch chủ và 2 trường hợp giả phình động mạch, Quint và cộng sự đã chứng minh rằng CT có độ chính xác 92% trong việc chẩn đoán các bất thường của động mạch chủ ngực. Ngoài ra, CT đã giúp dự đoán chính xác nhu cầu ngừng tuần hoàn hạ thân nhiệt (hypothermic circulatory arrest) trong quá trình phẫu thuật sửa chữa ở 94% bệnh nhân.
Mặc dù mặt phẳng axial vẫn là mặt phẳng quan trọng của việc diễn giải hình ảnh, các kỹ thuật tái tạo lại 2D và 3D như hình ảnh cường độ tối đa (MIP – maximum intensity projection), tái tạo mặt phẳng cong, tái tạo đa mặt phẳng (MPR – multiplanar reformation) và tái tạo thể tích (VR) có thể tạo điều kiện thuận lợi cho việc diễn giải hình ảnh và cải thiện sự giao tiếp với các bác sĩ điều trị. Theo hiểu biết của chúng tôi, chưa có bằng chứng khoa học nào cho thấy việc sử dụng các công cụ này làm tăng độ chính xác chẩn đoán hoặc sự tự tin trong chẩn đoán. Ví dụ, trong nghiên cứu của Quint và cộng sự, việc sử dụng hình ảnh tái tạo đa mặt phẳng (MPR) cùng với hình ảnh trên mặt phẳng axial chỉ thay đổi cách diễn giải hình ảnh trong một trường hợp. Cần lưu ý rằng nghiên cứu của họ liên quan đến việc chụp CT được thực hiện trên máy CT xoắn ốc một mặt cắt (single-section helical scanners) và được diễn giải bởi các chuyên gia chẩn đoán hình ảnh ngực, có thể có nhiều kinh nghiệm hơn trong việc đánh giá kết quả chụp CT ngực.
Hình ảnh tái tạo mặt phẳng chếch cắt theo hai hướng khác nhau (Double oblique reformatted images) thu được vuông góc với lòng động mạch chủ (tức là hình ảnh trục ngắn thực sự của động mạch chủ) cho phép đo đường kính động mạch chủ chính xác hơn so với việc dựa vào hình ảnh CT mặt phẳng axial, trên mặt phẳng axial thì động mạch chủ có đường đi chếch (oblique course) (Hình 10).
Báo cáo chuẩn của chúng tôi mô tả động mạch chủ ngực bao gồm các phép đo đường kính động mạch chủ (trung bình, nhỏ nhất và lớn nhất) tại các vị trí cụ thể (Bảng 2), cho phép ghi lại kích thước tại các vị trí này và thay đổi theo thời gian. Một hạn chế tiềm ẩn khi sử dụng các phép đo thu được từ các hình ảnh tái tạo mặt phẳng chếch cắt theo hai hướng khác nhau có sẵn gần đây là thực tế rằng dữ liệu liên quan đến kích thước động mạch chủ và nguy cơ vỡ đều dựa trên các phép đo lấy từ mặt phẳng axial. Hình ảnh tái tạo mặt phẳng cong (Curved planar reformatted images) có thể hữu ích trong phình động mạch có bóc tách động mạch, giúp mô tả lỗ xuất phát của các nhánh động mạch chủ so với lá nội mạc (intimal flap).
Hình 10. Các phép đo đường kính động mạch chủ. (a) Chụp CT có tiêm thuốc tương phản mặt phẳng axial của động mạch chủ ngực xuống cho thấy đường kính động mạch chủ là 23.4 mm (3D = ba chiều). (b) Hình chụp CT tái tạo mặt phẳng chếch cắt theo hai hướng khác nhau của động mạch chủ ngực xuống thu được ở cùng mức cho thấy động mạch chủ có mặt cắt ngang thực sự, với đường kính là 18.5 mm (3D = ba chiều). Đường kính động mạch chủ được ước tính quá mức trên mặt phẳng axial, cho thấy đường đi động mạch chủ chạy chếch.
Đặc điểm hình thái phình động mạch chủ ngực
Phình động mạch chủ ngực (TAA) có thể được phân loại là phình động mạch thật (true aneurysms) hoặc phình động mạch giả (false aneurysms) (giả phình động mạch- pseudoaneurysms). Phình động mạch thật chứa cả ba lớp giải phẫu—lớp nội mạc, lớp trung mạc và lớp ngoại mạc—thường liên quan đến giãn động mạch chủ dạng hình thoi và thường là do xơ vữa động mạch. Mặc dù phần lớn phình động mạch do xơ vữa động mạch là dạng hình thoi (fusiform), nhưng có tới 20% có thể là dạng túi (saccular). Giả phình động mạch có ít hơn ba lớp và được bao bọc bởi lớp ngoại mạc hoặc mô quanh lớp ngoại mạc. Giả phình động mạch thường là dạng túi với cổ túi hẹp và thường là do chấn thương (Hình 7), loét mảng xơ vữa xuyên thành (PAU) hoặc nhiễm trùng (phình động mạch dạng hình nấm).
Vị trí phình động mạch có thể cung cấp thông tin quan trọng về nguyên nhân của phình động mạch. Trong một nghiên cứu của 249 trường hợp phình động mạch chủ và các nhánh của nó do Fomon và cộng sự thực hiện, hầu hết phình động mạch được thấy ở động mạch chủ bụng (30.9% trường hợp), trong khi phình động mạch chủ ngực (TAA) thường được thấy nhất ở động mạch chủ lên (22.1%). Phình quai động mạch chủ, phình động mạch chủ xuống và phình động mạch chủ ngực bụng được thấy lần lượt là 11.6%, 7.6% và 2.8% các trường hợp.
Chỉ liên quan đến động mạch chủ lên thường kết hợp với giãn gốc động mạch chủ (annuloaortic ectasia), bệnh giang mai, phình động mạch sau phẫu thuật (tại đường khâu động mạch chủ hoặc tại vị trí đặt ống thông động mạch chủ), bệnh lý van động mạch chủ hoặc viêm động mạch chủ do nhiễm trùng hoặc không do nhiễm trùng. Ngược lại, xơ vữa động mạch là một quá trình lan tỏa hơn và hiếm khi chỉ liên quan đến động mạch chủ lên. Giả phình động mạch chủ lên sau phẫu thuật (Postoperative ascending aortic pseudoaneurysms) có thể xảy ra tại vị trí rạch vào động mạch chủ, vị trí đặt ống thông tim phổi nhân tạo hoặc vị trí chọc kim (chọc kim để đo áp lực, để đẩy khí ra khỏi động mạch chủ hoặc tiêm dung dịch gây tê liệt tim (cardioplegic solution)) hoặc tại các đường khâu không đủ tốt. Kẹp ngang động mạch chủ lên bị xơ vữa cũng có thể gây ra bóc tách động mạch chủ hoặc giả phình động mạch do bác sĩ gây ra.
Hình 11 cho thấy các vị trí tiềm ẩn của giả phình động mạch chủ lên sau phẫu thuật này. Phình động mạch chủ dạng túi do chấn thương thường gặp nhất ở eo động mạch chủ, trong khi phình động mạch dạng túi do loét mảng xơ vữa xuyên thành (PAU) có thể xảy ra ở bất kỳ vị trí nào ở động mạch chủ xuống.
Hình 11. Hình ảnh tái tạo thể tích (VR) 3D cho thấy các vị trí tiềm ẩn của giả phình động mạch chủ lên sau phẫu thuật. C = vị trí kẹp động mạch (clamping site), Cn = vị trí đặt ống thông (cannulation site), G = ống ghép (graft), GA = vị trí nối của ống ghép (graft anastomosis), N = vị trí chọc kim (needle puncture site), v = vị trí mở van động mạch chủ (valvulotomy site).
Các hình ảnh giống với phình động mạch chủ ngực
Điều quan trọng là phải nhận biết được các biến thể (variants) bình thường có thể giống với phình động mạch chủ, trong đó có hai biến thể là túi thừa ống động mạch (ductus diverticulum) và giãn nhẹ hình thoi đoạn gần động mạch chủ xuống (aortic spindle).
Túi thừa ống động mạch (ductus diverticulum)
Túi thừa ống động mạch bao gồm một cấu trúc lồi ra khu trú dọc theo mặt dưới phía trước vùng eo của quai động mạch chủ. Mặc dù túi thừa ống động mạch thường được cho là phần còn lại (remnant) của ống động mạch đã đóng, nhưng có ý kiến cho rằng túi thừa ống động mạch thực sự có thể là phần còn lại của gốc động mạch chủ lưng bên phải (right dorsal aortic root). Điều đặc biệt quan trọng là phải phân biệt túi thừa ống động mạch với giả phình động mạch chủ sau chấn thương, thường xảy ra nhất ở eo động mạch chủ. Ngược lại với giả phình động mạch, túi thừa ống động mạch có bờ trơn láng (smooth margins) với hai bên thành của miệng túi thừa dốc nhẹ đối xứng (gently sloping symmetric shoulders) và tạo góc tù với thành động mạch chủ (Hình 12).
Hình 12. Túi thừa ống động mạch (Ductus diverticulum) ở bệnh nhân nam 35 tuổi. Túi thừa ống động mạch này được thấy khi chụp CT động mạch chủ ngực. Hình ảnh CT tái tạo theo mặt phẳng axial (a) và mặt phẳng sagittal (b) cho thấy một cấu trúc cong lồi ra khu trú (mũi tên) dọc theo mặt trước của eo động mạch chủ. Ghi nhận tạo góc tù (obtuse angles) với thành động mạch chủ, không giống với giả phình động mạch.
Giãn nhẹ hình thoi đoạn gần động mạch chủ xuống (aortic spindle)
Giãn nhẹ hình thoi đoạn gần động mạch chủ xuống (Aortic spindle) là một cấu trúc lồi ra theo chu vi, bờ trơn láng nằm bên dưới đoạn eo ở phần đầu tiên của động mạch chủ xuống (Hình 13) và không nên nhầm lẫn với phình động mạch.
Hình 13. Giãn nhẹ hình thoi đoạn gần động mạch chủ xuống (Aortic spindle). Hình ảnh tái tạo thể tích (VR) ba chiều cho thấy giãn nhẹ hình thoi đoạn gần động mạch chủ xuống (mũi tên) là một cấu trúc phồng ra theo chu vi ở đoạn gần của động mạch chủ ngực xuống.
Biến chứng
Vỡ (Rupture)
Nguy cơ vỡ phình động mạch chủ ngực (TAA) tăng theo kích thước của phình động mạch. Điều này phù hợp với định luật Laplace, trong đó nói rằng sức căng thành động mạch tăng theo đường kính của động mạch chủ. Sửa chữa phình động mạch có kế hoạch có tỷ lệ tử vong thấp hơn (9%) so với sửa chữa phình động mạch cấp cứu (22%); do đó, phình động mạch được xem xét sửa chữa khi chúng có triệu chứng hoặc có đường kính vượt quá 5–6 cm.
Coady và cộng sự đã mô tả kích thước trung bình của vỡ-bóc tách (rupture-dissection) của phình động mạch chủ lên và động mạch chủ xuống lần lượt là 5.9 và 7.2 cm, và khuyến cáo can thiệp phẫu thuật đối với phình động mạch chủ lên > 5.5 cm và đối với phình động mạch chủ xuống > 6.5 cm. Can thiệp sớm hơn được khuyến cáo ở những bệnh nhân mắc hội chứng Marfan và được chỉ định khi đường kính động mạch chủ là 5 cm. Điều quan trọng là phải theo dõi kích thước của phình động mạch bằng CT mỗi năm một lần, vì có sự thay đổi trong tốc độ phát triển mỗi năm của phình động mạch (0.07–0.42 cm). Tốc độ phát triển mỗi năm > 1 cm là chỉ định được chấp nhận để phẫu thuật sửa chữa.
CT là phương thức lựa chọn để xác định vỡ phình động mạch. Phình động mạch chủ có thể vỡ vào trung thất (mediastinum), khoang màng phổi (Hình 14), màng ngoài tim hoặc các cấu trúc dạng ống kế cận như đường thở hoặc thực quản, biểu hiện dưới dạng tụ máu có đậm độ cao (high-attenuation hematoma) trên hình chụp CT thì không tiêm thuốc tương phản và thậm chí là thoát mạch thuốc tương phản (contrast material extravasation) ra khỏi lòng động mạch chủ trên hình chụp CT thì có tiêm thuốc tương phản.
Dấu hiệu “hình liềm – crescent” có đậm độ cao trong huyết khối bám thành (mural thrombus) của phình động mạch chủ ngực (TAA) có thể cho thấy vỡ động mạch cấp tính được bao bọc lại (acute contained rupture) hoặc dọa vỡ (impending rupture), tương tự như được mô tả trong phình động mạch chủ bụng (AAA) (Hình 15). Một dấu hiệu khác của vỡ động mạch được bao bọc lại (contained rupture) là “dấu hiệu động mạch chủ che phủ – draped aorta sign”, trong đó thành động mạch chủ phía sau áp sát vào cột sống; tình trạng này được cho là hậu quả của thành động mạch chủ bị suy yếu (deficient aortic wall).
Hình 15. Phình động mạch chủ bụng (Abdominal aortic aneurysm) ở bệnh nhân nam 75 tuổi. Chụp CT không tiêm thuốc tương phản (a) và có tiêm thuốc tương phản (b) cho thấy dấu hiệu hình liềm đậm độ cao trong huyết khối bám thành (mural thrombus) của phình động mạch chủ, dấu hiệu của tình trạng dọa vỡ động mạch (impending rupture) hoặc có rò rỉ máu được bao bọc lại (contained leak).
Phình động mạch chủ ngực (TAA) có thể tiến triển thành đường thông thương rò rỉ (fistulous communication) vào cây khí phế quản (tracheobronchial tree), được gọi là rò động mạch chủ – phế quản (aortobronchial fistula), biểu hiện lâm sàng là ho ra máu (hemoptysis) và trên hình chụp CT là tổn thương đông đặc (consolidation) ở phổi lân cận do xuất huyết (Hình 16); đường rò thường không được thấy trên CT. Hầu hết các đường rò động mạch chủ – phế quản (90%) xảy ra giữa động mạch chủ xuống và phổi trái.
Sự thông thương rò vào thực quản (rò động mạch chủ – thực quản: aortoesophageal fistula) ít gặp hơn và thường biểu hiện với nôn ra máu (hematemesis) và nuốt khó (dysphagia). Rò động mạch chủ – thực quản là một biến chứng nặng có các dấu hiệu trên CT bao gồm tụ máu trung thất, phình động mạch chủ nằm rất sát với thực quản và hiếm khi thấy thoát mạch thuốc tương phản vào thực quản (Hình 17).
Hình 16. Rò động mạch chủ – phế quản (Aortobronchial fistula) ở bệnh nhân nam 50 tuổi bị ho ra máu. Chụp CT có tiêm thuốc tương phản cho thấy vỡ khu trú phình động mạch chủ ngực xuống, tổn thương đông đặc ở thùy dưới bên trái của phổi nằm kế cận và máu trong lòng phế quản (endobronchial blood) ở phế quản phân thùy của thùy dưới bên trái (mũi tên), các dấu hiệu hình ảnh phù hợp với rò động mạch chủ – phế quản.
Hình 17. Rò động mạch chủ – thực quản (Aortoesophageal fistula) ở bệnh nhân nam 73 tuổi. Chụp CT không tiêm thuốc tương phản (Nonenhanced) (a, b) và có tiêm thuốc tương phản (contrast-enhanced) (c) cho thấy rò động mạch chủ – thực quản và vỡ động mạch vào trong thực quản (intraesophageal rupture) của phình động mạch chủ ngực xuống dạng túi. Máu có đậm độ cao (High-attenuation blood) được thấy trong trung thất ở hình 17a và trong thực quản ở hình 17b.
Chèn ép các cấu trúc kế cận (Compression of Adjacent Structures)
Phình động mạch chủ ngực (TAA) có thể không có triệu chứng, nhưng khi kích thước đủ lớn, chúng có thể gây ra các triệu chứng bằng việc chèn ép các cấu trúc kế cận—ví dụ, hội chứng tĩnh mạch chủ trên (superior vena cava syndrome) do chèn ép tĩnh mạch chủ trên, thở rít (stridor) hoặc khó thở (dyspnea) do chèn ép đường thở, khàn giọng (hoarseness) do chèn ép dây thần kinh thanh quản quặt ngược (recurrent laryngeal nerve) và khó nuốt do chèn ép thực quản.
Hình ảnh sau phẫu thuật (Postoperative Imaging)
Hình ảnh bình thường sau phẫu thuật của động mạch chủ ngực có thể gây nhầm lẫn và có thể giống với bệnh lý; do đó, việc hiểu biết về các chi tiết phẫu thuật (surgical details) là vô cùng quan trọng trước khi diễn giải kết quả hình ảnh. Loại phẫu thuật sửa chữa được sử dụng dựa trên nhiều yếu tố, bao gồm mức độ của bệnh, tình trạng của mô và van động mạch chủ, lựa chọn ưu tiên của bệnh nhân và bác sĩ phẫu thuật, nhu cầu điều trị thuốc chống đông máu lâu dài và loại phẫu thuật trước đó (nếu có).
Ống ghép động mạch chủ (Aortic grafts) có thể là ống ghép từ mô (tissue grafts) (lấy từ mô của lợn (porcine)) hoặc ống ghép tổng hợp (synthetic in nature). Ống ghép từ mô (Tissue grafts) không thể phân biệt được với mô động mạch chủ tự nhiên của cơ thể (native aortic tissue) trên CT, trong khi ống ghép tổng hợp (synthetic grafts) có đậm độ cao hơn nên dễ thấy trên CT không tiêm thuốc tương phản. Hai kỹ thuật phổ biến để sửa chữa với ống ghép gốc động mạch chủ là ống ghép được đặt vào vị trí động mạch chủ phình bị cắt bỏ và nối với hai đầu động mạch chủ (interposition graft) và ống ghép lồng vào lòng động mạch chủ bị phình (inclusion graft).
Sau khi cắt bỏ đoạn động mạch chủ bị phình, một ống ghép xen kẽ (interposition graft) được khâu từ đầu đến cuối với động mạch chủ bình thường và các nhánh mạch máu (như động mạch vành). Một cấu trúc dạng vòng làm từ nỉ (Felt rings) và miếng đệm nhỏ (pledgets) thường được sử dụng để gia cố vị trí khâu nối và vị trí đặt ống thông. Những vật liệu này có thể giống với giả phình động mạch trên hình chụp CT có tiêm thuốc tương phản nhưng có thể dễ dàng được xác định do có đậm độ cao trên hình chụp CT không tiêm thuốc tương phản.
Một ống ghép nằm trong lòng (inclusion graft) được đưa vào lòng động mạch chủ, để lại một khoảng trống tiềm ẩn giữa động mạch chủ tự nhiên của cơ thể và ống ghép có thể hình thành huyết khối hoặc thậm chí cho thấy dòng máu chảy dai dẳng (Hình 18). Trong trường hợp huyết động ổn định, dòng máu chảy trong khoang quanh ống ghép không cần can thiệp.
Khi động mạch chủ xuống được sửa chữa bằng ống ghép (graft), động mạch chủ tự nhiên của cơ thể (native aorta) có thể được giữ lại tại chỗ và biểu hiện dưới dạng một vùng có đường cong không đều với vôi hóa đậm độ cao hoặc viền mô mềm bên ngoài, thường có dịch nằm giữa động mạch chủ tự nhiên của cơ thể và ống ghép.
Các biến chứng cần được theo dõi trong giai đoạn hậu phẫu bao gồm bung chỗ nối ống ghép (graft dehiscence) và nhiễm trùng. Việc bung ra đường khâu phẫu thuật có thể dẫn đến hình thành giả phình động mạch, cũng có thể ảnh hưởng đến động mạch vành được nối vào ống ghép (reimplanted coronary arteries).
Kỹ thuật “vòi voi – elephant trunk” được sử dụng ở những bệnh nhân bị bệnh lý phình động mạch lan tỏa và liên quan đến việc thay thế bằng ống ghép ở động mạch chủ lên và quai động mạch chủ có hoặc không có thay van. Đoạn tự do của ống ghép (graft) được để lại nhô vào động mạch chủ xuống đoạn gần, sau đó có thể được sửa chữa sau đó. Sự hiểu biết về quy trình phẫu thuật có thể tránh nhầm lẫn đoạn tự do của ống ghép với lá nội mạc bóc tách (Hình 19).
Hình 18. Thuốc tương phản (Contrast material) trong khoang quanh ống ghép (perigraft space) ở bệnh nhân nam 75 tuổi có ống ghép lồng vào lòng đoạn gốc động mạch chủ (inclusion root graft). Chụp CT theo dõi định kỳ cho thấy thuốc tương phản (mũi tên cong) trong khoang nằm giữa ống ghép lồng vào lòng đoạn gốc động mạch chủ và thành động mạch chủ tự nhiên của cơ thể bọc xung quanh, xuất phát từ chỗ khâu nối dạng “khuy áo – button” của động mạch vành phải (mũi tên thẳng).
Hình 19. Sửa chữa động mạch chủ bằng kỹ thuật “vòi voi – elephant trunk” ở bệnh nhân nữ 53 tuổi. (a) Chụp CT có tiêm thuốc tương phản cho thấy “vòi voi – elephant trunk” giống với lá nội mạc bóc tách. Ghi nhận dải vật liệu nỉ (felt strip) ở chỗ nối động mạch chủ đoạn xa (mũi tên). (b) Hình ảnh CT tái tạo lại theo mặt phẳng sagittal mô tả rõ ràng đầu xa của ống ghép quai động mạch chủ treo lơ lửng (dangling) vào động mạch chủ ngực xuống.
Can thiệp sửa chữa nội mạch động mạch chủ ngực là một thủ thuật phẫu thuật thay thế ở những bệnh nhân có nguy cơ cao khi phẫu thuật hoặc trong các trường hợp cấp cứu. Thủ thuật phẫu thuật – nội mạch (endovascular-surgical procedure) kết hợp có thể được thực hiện ở những bệnh nhân bị tổn thương quai động mạch chủ để có thể điều trị cho nhiều bệnh nhân hơn. Chụp CT động mạch sau thủ thuật thường được thực hiện tại thời điểm xuất viện; 3, 6 và 12 tháng kể từ thời điểm thủ thuật; và mỗi năm một lần sau đó.
Một biến chứng đặc biệt của sửa chữa nội mạch là rò rỉ nội mạch (endoleak), được định nghĩa là tăng bắt thuốc tương phản (contrast enhancement) nằm bên ngoài stent-graft. Endoleaks được chia thành bốn loại dựa trên nguồn cung cấp dòng máu: type I, rò rỉ tại vị trí gắn đầu gần và đầu xa của stent; type II, rò rỉ từ các nhánh động mạch; type III, khiếm khuyết stent-graft; và type IV, độ xốp của stent-graft (graft porosity) (Hình 20, 21).
Hình 20. Hình vẽ minh họa các loại endoleak khác nhau: type I, rò rỉ tại vị trí gắn đầu gần và đầu xa của stent; type II, rò rỉ từ các nhánh động mạch; type III, khiếm khuyết stent-graft; và type IV, độ xốp của stent-graft (graft porosity).
Hình 21. Endoleak ở bệnh nhân nam 69 tuổi đã trải qua sửa chữa nội mạch động mạch chủ ngực do phình động mạch. Hình ảnh CT tái tạo lại mặt phẳng coronal chếch cho thấy endoleak type II (mũi tên) liên tục với động mạch liên sườn (intercostal artery) (đầu mũi tên).
Không giống như ở động mạch chủ dưới thận (infrarenal aorta), endoleak type II không phổ biến ở động mạch chủ ngực và endoleak type I phổ biến hơn. Có một số dấu hiệu CT có thể giúp phân biệt giữa các loại endoleak khác nhau. Endoleak type I được thấy có sự thông thương với vị trí gắn đầu gần hoặc đầu xa của stent-graft, trong khi endoleak type II nằm ở ngoại vi của túi phình động mạch (aneurysm sac) mà không tiếp xúc với stent.
CT cũng có thể giúp thấy được các mạch máu thông với khoang endoleak (Hình 21); tuy nhiên, sự tăng bắt thuốc tương phản trong các mạch máu này có thể cho thấy dòng chảy vào (inflow) (như trong endoleak type II) hoặc dòng chảy ra (outflow) (từ endoleak khác mà không phải type II). Endoleak type III thường biểu hiện xung quanh stent-graft trong khi vẫn bảo tồn phần ngoại vi của túi phình. Khi nghi ngờ endoleak type III, CT cũng có thể được sử dụng để đánh giá tính toàn vẹn của stent-graft.
Endoleak type IV thứ phát do độ xốp của stent-graft không phổ biến với các loại stent-graft ngày nay và được xác định là có “blush: sự xuất hiện mờ nhạt của thuốc tương phản trong túi phình” trên phim chụp mạch máu được thực hiện ngay sau khi đặt stent-graft khi bệnh nhân được dùng thuốc chống đông hoàn toàn. Chẩn đoán endoleak type IV là chẩn đoán loại trừ, vì các loại endoleak khác có thể xuất hiện trên phim chụp mạch máu sau khi đặt stent-graft và cần được loại trừ các loại này.
Việc xác định đúng loại endoleak có ý nghĩa quan trọng trong điều trị. Endoleak type I và type III được sửa chữa ngay lập tức, endoleak type I được sửa chữa bằng cách cố định các vị trí gắn đầu gần hoặc đầu xa của stent-graft bằng bóng nong mạch máu (angioplasty balloons), stent hoặc stent-graft mở rộng và endoleak type III được sửa chữa bằng cách che phủ chỗ khiếm khuyết với stent-graft mở rộng (stent-graft extension). Điều trị endoleak type II còn đang tranh cãi (controversial), và mặc dù một số bác sĩ theo dõi loại endoleak này miễn là kích thước của phình động mạch không tăng lên, những bác sĩ khác ưu tiên sửa chữa loại này. Endoleak type IV tự giới hạn, không cần điều trị và tự hết khi tình trạng đông máu của bệnh nhân trở về bình thường.
Sự giãn ra của phình động mạch mà không có endoleak được gọi là tăng áp lực trong phình động mạch (endotension) hoặc endoleak type V. Mặc dù nguyên nhân chính xác của endoleak này vẫn chưa được biết rõ, nhưng các nguyên nhân có thể bao gồm có endoleak mà không thể thấy được bằng các kỹ thuật chụp CT thông thường, siêu lọc máu qua ống ghép (ultrafiltration of blood across the graft) và huyết khối tạo ra một hàng rào không hiệu quả (ineffective barrier) đối với sự truyền áp lực máu (pressure transmission).
Kết luận
Chụp động mạch CT đa dãy đầu dò (MDCT) thường được sử dụng để đánh giá hình ảnh phình động mạch chủ ngực (TAA). Sự hiểu biết về nguyên nhân, ý nghĩa, đặc điểm hình ảnh và các biến chứng tiềm ẩn của cả phình động mạch chủ thường gặp và ít gặp là điều cần thiết để chẩn đoán nhanh chóng (prompt) và chính xác (accurate).
Tài liệu tham khảo
Multidetector CT of Thoracic Aortic Aneurysms
Có thể tham khảo thêm một số tài liệu sau:
Multimodality Imaging of Thoracic Aortic Diseases in Adults
Imaging Thoracic Aortic Aneurysm
Người dịch: Bs Lê Thị Ny Ny – Anhvanyds
Để lại một phản hồi Hủy