Vỡ phình động mạch chủ bụng (Rupture of an abdominal aortic aneurysm) thường là tình trạng gây tử vong. Các dấu hiệu chụp cắt lớp vi tính (CT) đa dãy đầu dò của vỡ động mạch chủ hoàn toàn (frank aortic rupture) thường dễ thấy và được hiểu biết rộng rãi. Tuy nhiên, chẩn đoán dọa vỡ động mạch chủ (impending aortic rupture) dựa trên các dấu hiệu hình ảnh có thể khó chẩn đoán hơn. CT là phương thức chủ yếu được sử dụng để theo dõi những bệnh nhân bị phình động mạch chủ và có thể cho thấy các dấu hiệu hình ảnh chỉ ra tình trạng không ổn định phình động mạch chủ. Do đó, điều quan trọng là các bác sĩ chẩn đoán hình ảnh phải nắm được các dấu hiệu trên CT về tình trạng không ổn định phình động mạch chủ để tránh các biến chứng tiềm ẩn như xuất huyết, thiếu máu cục bộ ở cơ quan đích hoặc ở chi và tử vong.
Các chỉ số CT trước phẫu thuật khác nhau đã được mô tả trước đây trong các nghiên cứu và các bài báo tổng quan. Kích thước ban đầu lớn của phình động mạch và kích thước tăng nhanh theo thời gian có liên quan đến nguy cơ vỡ cao hơn. Sự quan trọng của việc có được các phép đo chính xác với các hình ảnh tái tạo đa mặt phẳng (MPR) và vai trò của các công cụ bán tự động (semiautomated tools) mới để có được các phép đo chính xác, có thể tái tạo sẽ được thảo luận bên dưới.
Các dấu hiệu hình ảnh trên CT thêm vào giúp cho thấy tình trạng không ổn định của phình động mạch chủ bao gồm sự giãn ra của lòng động mạch với sự ly giải huyết khối (lysis of thrombus), xuất huyết trong thành động mạch (intramural hemorrhage) (dấu hiệu hình liềm – crescent sign), xuất huyết quanh động mạch chủ (periaortic hemorrhage), loét mảng xơ vữa xuyên thành (penetrating atherosclerotic ulcer) và vỡ động mạch chủ có các cấu trúc xung quanh bao bọc lại (contained rupture) (dấu hiệu động mạch chủ che phủ – draped aorta sign). Sau khi sửa chữa phình động mạch chủ bằng mổ mở hoặc can thiệp nội mạch, CT thường được sử dụng để theo dõi các biến chứng của ống ghép (graft). Trong trường hợp này, các bác sĩ chẩn đoán hình ảnh nên hiểu rằng sự hiện diện của stent nội mạch (endoluminal stent) hoặc ống ghép phẫu thuật (surgical graft) không loại trừ vỡ động mạch chủ.
Giới thiệu
Phình động mạch chủ bụng (AAA) được định nghĩa là tình trạng giãn ra bệnh lý của động mạch chủ bụng > 3 cm ở đường kính lớn nhất. Phình động mạch chủ bụng vẫn là nguyên nhân gây tử vong hàng đầu tại Hoa Kỳ, với ít nhất 45.000 ca phẫu thuật và 4500 ca tử vong do vỡ động mạch tại Hoa Kỳ mỗi năm.
Bệnh sinh (pathogenesis) của phình động mạch là đa yếu tố. Các yếu tố về môi trường, lối sống và di truyền, kết hợp với xơ vữa động mạch (atherosclerosis), dẫn đến tổn thương nội mạc, với sự thâm nhập của đại thực bào chứa đầy lipid và tế bào lympho vào thành động mạch chủ. Các tế bào viêm này tiết ra cytokine, kích hoạt nhiều chuỗi phản ứng phân giải protein. Khi các protein cấu trúc collagen và elastin bị phân hủy trong lớp trung mạc (tunica media), thành động mạch chủ bị suy yếu và dễ bị giãn ra hơn. Đặc biệt, động mạch chủ bụng dưới thận (infrarenal abdominal aorta) có nồng độ elastin và mạch máu nuôi mạch máu (vasa vasorum) ít hơn tự nhiên, khiến nó đặc biệt dễ hình thành phình động mạch.
Khoảng 90% phình động mạch chủ bụng là ở dưới thận (infrarenal). Phình động mạch chủ bụng dạng hình thoi (Fusiform abdominal aneurysms) là thường gặp nhất (chiếm 80% các trường hợp) và xuất phát trong tình trạng thoái hóa thành động mạch do xơ vữa (atherosclerotic degeneration). Phình động mạch dạng túi (Saccular aneurysms) ít gặp hơn, có hình cầu (spherical) hơn với cổ hẹp hơn (narrower neck) và có thể phát sinh thứ phát do loét xuyên thành hoặc có nguồn gốc của viêm (inflammatory) hoặc nhiễm trùng (infectious).
Mục tiêu của chụp CT nối tiếp trước phẫu thuật là xác định kích thước (size) và tốc độ phát triển (growth rate) của phình động mạch và xác định các dấu hiệu hình ảnh cho thấy tình trạng không ổn định của phình động mạch. Các yếu tố nguy cơ vỡ động mạch chủ bao gồm nữ giới (vỡ động mạch thường gặp hơn ở phụ nữ từ 2 đến 4 lần), đường kính phình động mạch ban đầu lớn hơn, tăng huyết áp, hút thuốc lá kéo dài, thể tích thở ra gắng sức (forced expiratory volume) trong 1 giây thấp và tiền sử ghép tim hoặc ghép thận.
Nguy cơ vỡ phình động mạch (aneurysm rupture) có liên quan trực tiếp đến cả kích thước và tốc độ giãn ra của động mạch. Chẩn đoán lâm sàng về tình trạng dọa vỡ động mạch chủ có thể là khó khăn vì bệnh nhân có thể hoàn toàn không có triệu chứng hoặc có biểu hiện đau bụng hoặc đau lưng không đặc hiệu. Ngoài tình trạng giãn lớn (enlargement) động mạch nhanh, một số dấu hiệu hình ảnh trên CT chỉ ra tình trạng không ổn định của phình động mạch đã được mô tả. Trong bài viết này, chúng ta sẽ xem xét những dấu hiệu này và chứng minh các đặc điểm của chúng trên hình ảnh mặt phẳng axial và tái tạo đa mặt phẳng (multiplanar reconstructions – MPR), vốn đã trở thành tiêu chuẩn chăm sóc để đánh giá tình trạng động mạch chủ.
Kỹ thuật chụp cắt lớp vi tính
Máy chụp CT đa dãy đầu dò thế hệ hiện nay (Current-generation) (64 lát cắt trở lên) tạo ra các tập dữ liệu có độ phân giải không gian và độ tương phản cao, được tạo ra nhờ các đầu dò hẹp (narrow detectors) (ví dụ: 0.5–0.6 mm) và tốc độ thu thập hình ảnh nhanh. Việc sử dụng nồng độ cao hơn (iodine, 350–370 mg/mL) của thuốc tương phản đường tĩnh mạch đã được chứng minh là cải thiện độ chính xác chẩn đoán khi chụp CT mạch máu (CTA – CT angiography).
Tốc độ tiêm thuốc phải đạt ít nhất 5 mL/giây và thậm chí cao hơn (5–7 mL/giây) ở những bệnh nhân lớn tuổi. Protocol chụp động mạch chủ chuẩn là thu thập hình ảnh duy nhất thì động mạch sớm (single early arterial phase). Với tốc độ tiêm thuốc và tốc độ thu thập dữ liệu nhanh, việc tính toán thời gian cẩn thận là rất quan trọng, đặc biệt là ở những bệnh nhân lớn tuổi bị rối loạn chức năng tim. Với việc bolus tracking tại động mạch chủ ngực xuống (descending thoracic aorta), hình ảnh nên được chụp ở 200 HU với máy chụp 64 lát cắt hoặc 230–250 HU với máy chụp 128 lát cắt cho thì động mạch sớm.
Nhìn chung, chụp CT động mạch chủ nối tiếp (serial aortic imaging) được thực hiện với một lần chụp duy nhất ở thì động mạch sớm. Ở những bệnh nhân có phình động mạch kích thước lớn, kỹ thuật bolus tracking có thể không tạo ra hình ảnh phình động mạch lấp đầy với thuốc tương phản hoàn toàn, cần thêm thời gian để làm tăng đậm độ hoàn toàn bằng thuốc tương phản (contrast material). Cạm bẫy (pitfall) này có thể dẫn đến việc bắt thuốc tương phản không tối ưu (suboptimal enhancement) ở các nhánh động mạch chủ. Ngoài ra, khi vỡ phình động mạch kích thước lớn, hiện tượng thoát mạch thuốc tương phản (contrast material extravasation) cho thấy tình trạng xuất huyết đang hoạt động (active hemorrhage) có thể không rõ ràng ở thì động mạch sớm nhưng có thể thấy rõ trên hình ảnh chụp ở thì động mạch muộn hoặc thì tĩnh mạch sau khi phình động mạch lấp đầy thuốc tương phản (Hình 1).
Chỉ định cho các lần chụp bổ sung cũng bao gồm việc sử dụng các thì chụp không tiêm thuốc tương phản và thì tĩnh mạch trễ (delayed venous phases) sau khi sửa chữa stent nội mạch, trong đó chúng tôi sử dụng thì trễ ở 60 giây. Việc chụp thì không tiêm thuốc tương phản giúp phân biệt vôi hóa (calcification) hoặc vật liệu phẫu thuật (surgical material) bên trong túi phình động mạch (aneurysm sac) với endoleak (rò rỉ thuốc tương phản ra ngoài stent-graft) và có thể giúp mô tả tụ máu trong thành hoặc quanh động mạch chủ, và các lần chụp ở thì trễ có thể cho thấy endoleak, tình trạng mà không được thấy rõ trong thì động mạch.
Tái tạo lát cắt mỏng rất quan trọng đối với cả đánh giá trước và sau phẫu thuật, cho phép đánh giá đa mặt phẳng chi tiết ở bệnh nhân trước phẫu thuật. Sau khi sửa chữa stent trong lòng mạch, tái tạo lát cắt mỏng hơn cải thiện khả năng quan sát stent-graft có lỗ (fenestrated grafts) và endoleaks. Trong thực hành của chúng tôi, các mặt phẳng axial được tái tạo ở kích thước 3 × 3 mm và MPR mặt phẳng coronal và sagittal được tạo ra tại máy chụp từ dữ liệu gốc cho từng trường hợp. Thể tích (volume) có độ phân giải cao (0.75 × 0.5 mm) cũng được gửi đến hệ thống lưu trữ và truyền đạt thông tin hình ảnh (PACS – picture archiving and communication system) cho từng trường hợp để cho phép tạo ra MPR 2D tương tác (interactive two-dimensional MPRs) khi được chỉ định và đến một trạm làm việc ba chiều (3D) chuyên biệt để bác sĩ chẩn đoán hình ảnh dựng hình 3D tương tác (interactive 3D rendering).
Hình 1. Phình động mạch chủ ngực bụng vỡ (Ruptured thoracoabdominal aortic aneurysm) ở bệnh nhân nữ 84 tuổi.
(a–c) Hình ảnh CT với MPR mặt phẳng axial (a, b) và mặt phẳng coronal (c) thu được trong thì động mạch sớm có tiêm thuốc tương phản đường tĩnh mạch và bolus tracking động mạch chủ ngực xuống (descending thoracic aorta) cho thấy tụ máu quanh động mạch chủ (periaortic hematoma) (các mũi tên trong a và b) nhưng không có thoát mạch thuốc tương phản đang hoạt động. Hình ảnh mặt phẳng axial cho thấy phình động mạch kích thước lớn chưa lấp đầy hoàn toàn thuốc tương phản (ghi nhận sự chuyển đổi dần của máu không tăng đậm độ rõ (unopacified blood) và thuốc tương phản trong lòng động mạch). Các nhánh của động mạch chủ, như động mạch thận bên phải (đầu mũi tên trong b), vẫn không lấp thuốc tương phản.
(d, e) Hình ảnh CT với MPR mặt phẳng coronal thu được bằng thuốc tương phản tiêm đường tĩnh mạch ở thì động mạch muộn (late arterial phase) cho thấy thuốc tương phản thoát mạch ra ngoài (mũi tên), một dấu hiệu phù hợp với xuất huyết đang hoạt động (active hemorrhage), việc chứng minh tình trạng này cần phải chụp ở thời gian chậm hơn một chút để phình động mạch chủ kích thước lớn có thể lấp đầy thuốc tương phản.
Hình ảnh nối tiếp và phép đo đạc phình động mạch (Serial Aneurysm Imaging and Measurement)
Vai trò chính của chụp hình ảnh nối tiếp (serial imaging) là đánh giá kích thước phình động mạch. Ngưỡng phẫu thuật để sửa chữa phình động mạch thay đổi phụ thuộc vào vị trí của phình động mạch, nhưng hầu hết các bác sĩ phẫu thuật mạch máu đều lựa chọn sửa chữa phình động mạch chủ bụng dạng hình thoi điển hình có đường kính lớn nhất > 5.4 cm. Tốc độ giãn ra trung bình của phình động mạch chủ bụng là 3.2 mm mỗi năm, với tốc độ phát triển tương quan với kích thước phình động mạch theo định luật Laplace.
Hầu hết phình động mạch chủ bụng phát triển 1–4 mm mỗi năm và nguy cơ vỡ so với nguy cơ phẫu thuật được cân bằng ở ngưỡng can thiệp là 5.0–5.5 cm. Phẫu thuật sửa chữa được chỉ định cho phình động mạch giãn ra hơn 5–7 mm trong vòng 6 tháng hoặc 1 cm trở lên trong vòng 1 năm. Trong một số trường hợp, tình trạng giãn ra nhanh hoặc tiền sử gia đình có người bị vỡ động mạch có thể chỉ định sửa chữa động mạch sớm.
Hình ảnh CT mặt phẳng axial là phương pháp truyền thống (traditional method) để đo phình động mạch. Tuy nhiên, các phép đo này dễ bị sai vì động mạch chủ giãn ra trở nên ngoằn ngoèo (tortuous) và không chạy vuông góc trực tiếp với mặt phẳng axial. Thay vào đó, các phép đo phình động mạch hai chiều chính xác nhất là các phép đo vuông góc với đường trung tâm chạy dọc động mạch chủ (đo vuông góc theo trục mạch máu). Do đó, việc sử dụng các kỹ thuật tái tạo đa mặt phẳng (MPR – multiplanar reconstruction) để diễn giải và hiển thị các phép đo là tiêu chuẩn chăm sóc hiện tại để phân tích phình động mạch chính xác (Hình 2). Người ta đã chứng minh rằng phép đo phình động mạch bằng hình ảnh tái tạo 3D dẫn đến sự khác nhau giữa các bác sĩ đọc phim thấp hơn đáng kể so với chỉ đo ở các mặt phẳng axial.
Máy chụp hiện đại có khả năng thu thập dữ liệu với độ dày đầu dò dưới milimét (submillimeter detector thickness), tạo ra các thể tích CT đẳng hướng (isotropic CT volumes) có thể được tái tạo với độ phân giải đầy đủ ở bất kỳ mặt phẳng nào. Ngoài ra, hầu hết các hệ thống PACS hiện đại đều cung cấp trực tiếp hoặc cho phép tạo ra các hình ảnh tái tạo theo mặt phẳng sagittal, coronal và oblique (chếch) thủ công tại trạm làm việc (workstation). Để giảm sự khác biệt giữa các bác sĩ đọc phim, các phép đo phình động mạch chính xác đòi hỏi phải đo đạc lặp lại (repeat measurement) của các report trước đó bởi bác sĩ chẩn đoán hình ảnh diễn giải (interpreting radiologist). Các phép đo nối tiếp nên được thực hiện bằng cách so sánh các hình ảnh CT cũ nhất sẵn có cũng như hình ảnh trước đó gần nhất.
Các công cụ đo đạc bán tự động trên CT hiện sẵn có tại nhiều trạm làm việc. Kỹ thuật đường trung tâm (center line technique) là một công cụ đo đạc bán tự động để đo động mạch chủ. Sau khi người đọc chọn điểm bắt đầu và điểm kết thúc trên các hình ảnh tái tạo hai hoặc ba chiều, công cụ sẽ xác định đường trung tâm (center line) của động mạch chủ và tạo ra một hình tái tạo mặt phẳng cong kéo dài (elongated curved planar reconstruction), từ đó đường kính (diameter) và thể tích (volume) được tính toán tự động (Hình 2). Một vài nghiên cứu đã xác định rằng các công cụ bán tự động là phương pháp chính xác và đáng tin cậy để tạo ra các phép đo có thể tái tạo, với khả năng thay đổi tốt giữa các bác sĩ đọc phim và trong cùng một người đọc.
Hình 2. Phình động mạch chủ ngực bụng (Thoracoabdominal aortic aneurysm) ở bệnh nhân nam 59 tuổi.
(a) Hình ảnh CT với MPR mặt phẳng coronal thu được bằng thuốc tương phản đường tĩnh mạch cho thấy động mạch chủ gập góc (angulation), làm cho nó có hướng chếch (oblique orientation), khiến các phép đo đạc trên mặt phẳng axial là không chính xác.
(b) Hình ảnh CT mặt phẳng axial cho thấy kích thước tối đa của động mạch chủ bụng dưới thận là 6.5 cm khi đo trên mặt phẳng axial.
(c, d) Hình ảnh CT với MPR mặt phẳng coronal (c) và sagittal (d) cho thấy các phép đo thu được theo hướng vuông góc với trục dài của phình động mạch không lớn hơn 5 cm.
(e, f) Hình ảnh CT với MPR mặt phẳng coronal cho thấy việc sử dụng công cụ đo bán tự động, trong đó người đọc chọn điểm bắt đầu (e) và điểm kết thúc (f) của đoạn động mạch chủ cần đánh giá. (Hình 2 tiếp tục bên dưới).
Hình 2. (tiếp theo trường hợp trên).
(g, h) Hình ảnh CT với MPR mặt phẳng coronal cho thấy việc sử dụng công cụ đo bán tự động, trong đó máy tính theo dõi đường trung tâm (center line) của động mạch chủ (g), tạo ra hình ảnh mặt phẳng cong (curved planar image) có thể được làm thẳng ra ngay lập tức (h) để điều chỉnh lại sự gập góc của động mạch chủ.
(i) Hình ảnh CT với MPR mặt phẳng axial thu được vuông góc với trục dài của mạch máu và được làm thẳng ra ngay lập tức cho thấy đường kính lớn nhất, việc xác định đường kính này mang lại phép đo chính xác trên mặt phẳng axial.
Các dấu hiệu không ổn định của phình động mạch trước phẫu thuật trên CT (Preoperative CT Signs of Aneurysm Instability)
Các bác sĩ chẩn đoán hình ảnh phải biết các dấu hiệu hình ảnh trên CT về tình trạng không ổn định của phình động mạch vượt quá mức giãn ra nhanh chóng. Đánh giá cẩn thận với hình MPR đặc biệt quan trọng. Các dấu hiệu dọa vỡ (impending rupture) đã được mô tả trước đây và bao gồm dấu hiệu hình liềm tăng đậm độ (hyperattenuating crescent sign), thành động mạch không đều (wall irregularity), tụ máu quanh động mạch chủ (periaortic hematoma), túi phình (saccular outpouching) mới xuất hiện và dấu hiệu động mạch chủ che phủ (draped aorta sign).
Dấu hiệu hình liềm tăng đậm độ là vùng đường cong quanh lòng mạch (periluminal curvilinear area) tăng đậm độ bên trong thành động mạch hoặc huyết khối (thrombus) của động mạch chủ. Ở hình CT không tiêm thuốc tương phản, hình liềm có đậm độ cao hơn máu trong lòng mạch (Hình 3). Khi sử dụng thuốc tương phản đường tĩnh mạch, hình liềm có đậm độ cao hơn cơ thắt lưng (psoas muscle) (Hình 4). Về mặt mô bệnh học, dấu hiệu này là kết quả của sự thâm nhập của máu từ lòng động mạch chủ (aortic lumen) vào huyết khối bám thành (mural thrombus) xung quanh và/hoặc thành động mạch, làm tổn thương nghiêm trọng và làm suy yếu thành động mạch. Mehard và cộng sự đã báo cáo rằng dấu hiệu hình liềm tăng đậm độ có liên quan chặt chẽ với các dấu hiệu khác của tình trạng không ổn định động mạch chủ (aortic instability), cũng như vỡ động mạch hoàn toàn (frank rupture), và có độ đặc hiệu là 93%.
Điều quan trọng là xuất huyết trong thành (intramural hemorrhage) hình liềm không nên bị nhầm lẫn với huyết khối bám thành (mural thrombus) đồng nhất theo chu vi hoặc huyết khối bám thành giảm đậm độ lan tỏa, thường cùng tồn tại với phình động mạch chủ bụng (AAA). So sánh với các hình ảnh CT trước đó xác định sự xuất hiện mới giữa hai lần chụp (interval appearance) của dấu hiệu hình liềm tăng đậm độ giúp hỗ trợ chẩn đoán xuất huyết trong thành, đặc biệt ở những bệnh nhân có triệu chứng.
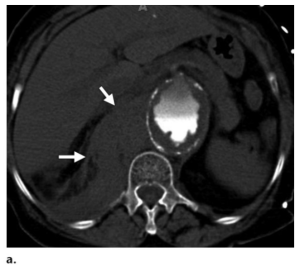
Hình 3. Phình động mạch chủ bụng không ổn định ở bệnh nhân nữ 60 tuổi (so sánh Hình 7). Hình ảnh CT không tiêm thuốc tương phản mặt phẳng axial cho thấy xuất huyết trong thành tăng đậm độ (hyperattenuating intramural hemorrhage) (các mũi tên), một dấu hiệu được gọi là dấu hiệu hình liềm (crescent sign) cho thấy phình động mạch không ổn định (aneurysm instability).
Hình 4. Phình động mạch chủ ngực bụng đang giãn lớn ra ở bệnh nhân nữ 76 tuổi có hút thuốc lá. Phình động mạch tăng gần 3 cm trong vòng chưa tới 2 năm. Hình ảnh CT với MPR mặt phẳng coronal ban đầu (baseline) (a) và theo dõi (follow-up) (b) cho thấy phình động mạch, tăng kích thước từ 5.9 cm lên 8.7 cm. (c) Hình ảnh CT theo dõi trên mặt phẳng axial cho thấy hình liềm tăng đậm độ (các mũi tên), một dấu hiệu gợi ý xuất huyết vào thành của phình động mạch và là dấu hiệu cho thấy tình trạng không ổn định của phình động mạch.
Phình động mạch bị vỡ (Ruptured aneurysms) đã được chứng minh là chứa ít huyết khối bám thành (mural thrombus) và vôi hóa huyết khối (thrombus calcification) hơn so với phình động mạch chưa vỡ. Tỷ lệ của lòng mạch thông thoáng (patent lumen) với huyết khối bám thành có thể cao hơn đáng kể so với phình động mạch ổn định hơn. Như tác giả Pillari đã ghi nhận, thể tích huyết khối giảm dần với sự giãn ra dần dần của lòng mạch dòng chảy (flow lumen) có thể cho thấy tình trạng huyết khối bị ly giải (lysis) và là một yếu tố nguy cơ khác gây vỡ động mạch. So sánh cẩn thận đặc điểm của huyết khối bám thành là rất quan trọng ở những bệnh nhân có đau và được thấy rõ nhất với hình MPR. Sự ăn mòn của mảng huyết khối (plaque erosion) hoặc túi phình lệch tâm của lòng mạch (eccentric outpouching of the lumen) mới xuất hiện có thể phản ánh tình trạng mất ổn định trong bối cảnh này (Hình 5).
Hình 5. Tình trạng không ổn định của phình động mạch ở bệnh nhân nữ 75 tuổi bị phình động mạch chủ ngực bụng (thoracoabdominal aortic aneurysm) đã biết trước, nhập khoa cấp cứu vì đau lưng cấp.
(a) Hình ảnh CT với MPR mặt phẳng coronal trước đó thu được bằng thuốc tương phản đường tĩnh mạch cho thấy phình động mạch chủ ngực bụng (mũi tên).
(b) Hình ảnh CT với MPR mặt phẳng coronal thu được trong tình trạng cấp tính lúc nhập viện cho thấy một vùng ăn mòn mới xuất hiện trên mảng (new area of plaque erosion) (mũi tên) dọc theo thành lớp trung mạc, một dấu hiệu phù hợp với sự không ổn định của phình động mạch, là nguyên nhân gây ra tình trạng đau của bệnh nhân. Sửa chữa nội mạch (Endovascular repair) được thực hiện 2 ngày sau đó, sau khi đặt ống dẫn lưu tủy sống trước khi làm thủ thuật (preprocedure placement of spinal drains) để giảm nguy cơ thiếu máu cục bộ tủy sống.
Sự hiện diện của tụ máu quanh động mạch chủ (periaortic hematoma) nằm cạnh phình động mạch chủ bụng cho thấy tình trạng mất tính toàn vẹn của thành động mạch trong phình động mạch và là yếu tố nguy cơ cao gây vỡ hoàn toàn (frank rupture). Trên CT, tụ máu quanh động mạch chủ biểu hiện như một vùng đậm độ mô mềm (soft-tissue attenuation) xuất phát từ động mạch chủ hoặc liên quan chặt chẽ với động mạch chủ. Tụ máu thường ở phía sau bên của động mạch chủ nhưng có thể lan dọc theo chu vi của động mạch (Hình 6). Có thể có thâm nhiễm mỡ (fat stranding) quanh phình động mạch và có thể lan ra ngoài ngay cạnh vùng quanh động mạch chủ (Hình 7).
Những cạm bẫy tiềm ẩn (Potential pitfalls) bao gồm nhầm lẫn với các cấu trúc lân cận (ví dụ, ruột non chưa bắt thuốc tương phản, các cấu trúc tĩnh mạch và hạch bạch huyết), viêm quanh phình động mạch hoặc xơ hóa (fibrosis) do xuất huyết. Một lần nữa, sự xuất hiện mới giữa 2 lần chụp của tụ máu quanh động mạch chủ so với lần khám trước, đặc biệt là ở bệnh nhân có triệu chứng, giúp hỗ trợ chẩn đoán dọa vỡ động mạch.
Hình 6. Phình động mạch chủ bụng và xuất huyết quanh phình động mạch ở bệnh nhân nữ 61 tuổi. Hình ảnh CT mặt phẳng axial cho thấy phình động mạch chủ bụng tăng hơn 1 cm đường kính trong vòng chưa tới 1 năm và xuất huyết quanh phình động mạch (các mũi tên). Động mạch chủ ngực bị vỡ 2 tuần sau đó.
Hình 7. Tình trạng không ổn định của phình động mạch và vỡ động mạch được bao bọc lại (contained rupture) ở bệnh nhân nữ 60 tuổi mắc nhiều bệnh lý nội khoa—bao gồm hội chứng kháng thể kháng phospholipid, viêm tụy mạn và ung thư thực quản—và tiền sử hút thuốc lá, nhập viện vì đau bụng.
(a, b) Hình ảnh CT cho thấy tổn thương dạng dải (stranding) mới xuất hiện ở trong phúc mạc (intraperitoneal) và sau phúc mạc (retroperitoneal) (các mũi tên), khi đánh giá lại, được xác định là xuất huyết (hemorrhage) và kích thước phình động mạch ổn định (stable aneurysm size). Vào thời điểm đó, tình trạng đau của bệnh nhân được cho là do loét tá tràng chảy máu (bleeding duodenal ulcers).
(c) Hình ảnh CT theo dõi mặt phẳng axial thu được bằng thuốc tương phản đường tĩnh mạch 1 tháng sau đó cho thấy phình động mạch giãn ra nhanh chóng với xuất huyết quanh phình động mạch mới xuất hiện.
(d) Hình ảnh CT mặt phẳng axial được chụp lại do đau bụng nhiều hơn trong quá trình đánh giá tim mạch trước phẫu thuật cho thấy phình động mạch tiếp tục giãn ra với xuất huyết trong thành động mạch, biểu hiện bằng dấu hiệu hình liềm và tụ máu quanh phình động mạch, các dấu hiệu phù hợp với tình trạng không ổn định của phình động mạch và vỡ động mạch được cấu trúc xung quanh bao bọc lại (contained rupture), được xác định lúc phẫu thuật.
Với tình trạng vỡ phình động mạch mạn tính được cấu trúc xung quanh bao bọc lại, mặc dù thành động mạch chủ không còn nguyên vẹn hoàn toàn, sự xuất huyết vẫn được bao bọc, thường là bởi huyết khối và/hoặc mô mềm sau phúc mạc. Bệnh nhân ổn định về mặt huyết động nhưng có thể đã từng bị đau bụng trước đó. Trên CT, các dấu hiệu vỡ phình động mạch được các cấu trúc xung quanh bao bọc lại (contained rupture) bao gồm sự phình ra dạng túi (saccular outpoutching) mới xuất hiện của thành động mạch chủ và sự che phủ (draping) của túi phình động mạch phủ qua thân đốt sống kế cận.
Cần lưu ý rằng tình trạng vôi hóa nội mạc không đều, không liên tục thường thấy ở cả phình động mạch ổn định và không ổn định. Tuy nhiên, tình trạng mất liên tục khu trú của mảng nội mạc vôi hóa theo chu vi và sự dịch chuyển hướng ra ngoài của mảng nội mạc vôi hóa (calcified intimal plaque) có thể cho thấy vỡ động mạch được các cấu trúc xung quanh bao bọc (contained rupture) trên CT không tiêm thuốc tương phản và chắc chắn cho thấy “contained rupture” nếu chúng là những dấu hiệu mới xuất hiện. Đánh giá trên MPR giúp xác định dạng hình túi của thành động mạch bị vỡ (Hình 8).
Hình 8. Giả phình động mạch khu trú (Focal pseudoaneurysm) ở bệnh nhân nữ 68 tuổi mắc bệnh lý xơ vữa động mạch lan tỏa.
(a, b) Hình ảnh CT không tiêm thuốc tương phản mặt phẳng axial (a) và mặt phẳng sagittal (b) ban đầu cho thấy chỗ nối động mạch chủ ngực – bụng (thoracoabdominal junction) (mũi tên trong hình a).
(c, d) Hình ảnh CT không tiêm thuốc tương phản mặt phẳng axial (c) và mặt phẳng coronal (d) theo dõi sau 2 năm cho thấy sự thay đổi khoảng cách của đường bờ động mạch chủ tại chỗ nối động mạch chủ ngực – bụng (mũi tên), một dấu hiệu liên quan đến vỡ động mạch chủ được cấu trúc xung quanh bao bọc lại (contained rupture).
(e) Hình ảnh CT với MPR mặt phẳng coronal thu được bằng thuốc tương phản đường tĩnh mạch vào ngày hôm sau cho thấy giả phình động mạch khu trú (focal pseudoaneurysm).
Dấu hiệu động mạch chủ che phủ (draped aorta sign) là một dấu hiệu khác của vỡ động mạch được bao bọc lại (contained rupture), đề cập đến thành sau của động mạch chủ bám sát hoặc “che phủ – draping” dọc theo đường bờ của thân đốt sống kế cận. Động mạch chủ có thể xuất hiện với ranh giới không rõ (indistinct) với thân đốt sống (vertebral body) hoặc cơ thắt lưng (psoas muscle), với tình trạng mất các mặt phẳng của mỡ quanh động mạch chủ. Một lần nữa, hình ảnh tái tạo đa mặt phẳng (MPR) cho thấy một túi phình ra dạng túi (saccular outpouching) chỉ ra tình trạng vỡ khu trú của thành phình động mạch ở vùng có biểu hiện che phủ (draping) trên mặt phẳng axial (Hình 9).
Mặt trước của thân đốt sống bị lõm vào (Anterior vertebral body scalloping) do vỡ động mạch mạn tính được bao bọc lại (chronic contained rupture) cũng đã được báo cáo và có thể hữu ích trong việc đưa ra chẩn đoán chính xác. Do mạch đập (pulsations) và áp lực (pressure) của động mạch chủ lặp đi lặp lại mạn tính, mặt trước của đốt sống được tái cấu trúc với bờ trơn láng trong trường hợp vỡ động mạch được bao bọc lại trái ngược với tình trạng ăn mòn không đều trong các trường hợp nhiễm trùng (infection) hoặc khối u ác tính (aggressive neoplasm). Điều thú vị và khác với các chỉ số khác của tình trạng không ổn định phình động mạch, Apter và cộng sự phát hiện ra rằng vỡ động mạch được bao bọc lại (contained ruptures) không liên quan đến kích thước phình động mạch.
Hình 9. Vỡ phình động mạch được bao bọc lại ở bệnh nhân nam 79 tuổi bị phình động mạch chủ bụng đã biết trước nhưng không có triệu chứng. Hình ảnh CT với MPR mặt phẳng sagittal (a) và axial (b) ban đầu và MPR mặt phẳng sagittal (c) và axial (d) theo dõi thu được bằng thuốc tương phản đường tĩnh mạch cho thấy một túi phình lệch tâm (eccentric outpouching) (mũi tên) của thành sau động mạch chủ làm biến dạng thân đốt sống và tiếp xúc với cơ thắt lưng trái, một dấu hiệu được gọi là dấu hiệu động mạch chủ che phủ (draped aorta sign). Cấu trúc hình túi điển hình của vỡ động mạch được bao bọc lại biểu hiện trên hình ảnh mặt phẳng sagittal theo dõi (c) và có sự tăng lên của tình trạng xuyên thấu từ lòng mạch (luminal penetration) vào vỡ động mạch được bao bọc lại (contained rupture). Bệnh nhân từ chối phẫu thuật.
– Loét mảng xơ vữa xuyên thành (Penetrating atherosclerotic ulcer – PAU) là biến chứng của bệnh lý xơ vữa động mạch chủ (aortic atherosclerosis) làm thành động mạch không ổn định, có nguy cơ loét lan rộng, hình thành phình động mạch dạng túi và vỡ động mạch chủ. Được định nghĩa là loét mảng xơ vữa động mạch lan rộng qua lớp nội mạc và vào lớp trung mạc, chủ yếu xảy ra ở động mạch chủ ngực nhưng cũng có thể ảnh hưởng đến động mạch chủ bụng. Động mạch chủ bụng bị ảnh hưởng ở 30% bệnh nhân trong một loạt 388 bệnh nhân. Trong một đánh giá có hệ thống về 283 bệnh nhân có 299 loét xuyên thành động mạch chủ bụng, hầu hết bệnh nhân (86%) là nam giới và chỉ có 29% biểu hiện đau lưng hoặc đau bụng.
+ Bệnh nhân có triệu chứng có nhiều khả năng xuất hiện các biến chứng hơn. Ngược lại với loét xuyên thành động mạch chủ ngực (thoracic aortic penetrating ulcers) tình trạng mà thường đi kèm với một số mức độ của tụ máu trong thành, chỉ có 9% bệnh nhân bị loét mảng xơ vữa xuyên thành (PAU) ở động mạch chủ bụng có tụ máu trong thành đi kèm theo, trong khi 30% bị phình động mạch dạng túi (Hình 10).
+ Gần 1/3 bệnh nhân đã được sửa chữa động mạch, với hầu hết (70%) các ca sửa chữa được thực hiện bằng phương pháp can thiệp nội mạch. Như đã ghi nhận trước đó, người ta biết rất ít về tiền sử tự nhiên của loét mảng xơ vữa xuyên thành (PAU) của động mạch chủ bụng không có triệu chứng và chỉ được điều trị nội khoa. Dữ liệu được trích dẫn rất đa dạng—từ một loạt 10 bệnh nhân không có biến chứng khi khám theo dõi đến 29% trong số 23 bệnh nhân có loét mảng xơ vữa xuyên thành (PAU) tiến triển (ví dụ, loét lan rộng, hình thành phình động mạch hoặc xuất huyết trong thành)—trên nhiều bệnh nhân. Các yếu tố được ghi nhận là ảnh hưởng đến tiên lượng bao gồm đường kính động mạch chủ bụng, kích thước hai chiều của vết loét (ulcer) và mức độ nghiêm trọng của tình trạng vôi hóa nội mạc.
Hình 10. Loét mảng xơ vữa xuyên thành (PAU) tiến triển thành phình động mạch dạng túi (saccular aneurysm) trong hơn 2 năm ở bệnh nhân nữ 61 tuổi. Hình ảnh CT với MPR mặt phẳng axial (a) và coronal (b) ban đầu, hình ảnh theo dõi sau 1 năm trên mặt phẳng axial (c) và coronal (d) và hình ảnh theo dõi sau 2 năm trên mặt phẳng axial (e) và coronal (f) cho thấy sự lan rộng ra dần dần của vết loét xuyên thành ở phía trên (mũi tên) ở động mạch chủ ngực xuống.
Dấu hiệu không ổn định của phình động mạch sau phẫu thuật trên CT (Postoperative CT Signs of Aneurysm Instability)
Với dân số bệnh nhân lớn tuổi, tỷ lệ mắc bệnh lý tim mạch ngày càng tăng và những tiến bộ trong kỹ thuật can thiệp nội mạch và phẫu thuật, số ca sửa chữa phình động mạch được thực hiện tiếp tục tăng lên. Các bác sĩ chẩn đoán hình ảnh phải quen thuộc với hình ảnh của các chỉ số sau can thiệp nội mạch và sau phẫu thuật của tình trạng không ổn định phình động mạch.
Vỡ phình động mạch chủ bụng muộn (Delayed abdominal aortic aneurysm rupture) sau khi sửa chữa phình động mạch qua can thiệp nội mạch (EVAR – endovascular aneurysm repair) là một biến chứng ít gặp nhưng đã biết trước đó. Nhiều bài viết đã xuất bản mô tả tỷ lệ vỡ động mạch sau sửa chữa phình động mạch qua can thiệp nội mạch (EVAR) dao động từ 0.4% đến 1.2%, với thời điểm vỡ dao động từ 3 ngày đến 85 tháng. Các yếu tố nguy cơ gây ra tình trạng không ổn định sau sửa chữa phình động mạch qua can thiệp nội mạch (EVAR) bao gồm sự di chuyển của stent graft (graft migration) > 5 mm, stent graft bị gập (kinking) hoặc gãy (fracture) và endoleaks dai dẳng (Hình 11, 12). Mặc dù chẩn đoán tình trạng stent graft sai vị trí hoặc bị gián đoạn thường đơn giản, nhưng việc phát hiện endoleak kín đáo có thể khó khăn hơn. Sự hiện diện của endoleak ít nhất là một yếu tố nguy cơ rất mạnh và có thể là điều kiện tiên quyết đối với vỡ phình động mạch chủ bụng muộn sau sửa chữa phình động mạch qua can thiệp nội mạch (EVAR).
– Đánh giá endoleak:
+ Endoleak type I là kết quả của rò rỉ máu ra xung quanh tại vị trí gắn của stent graft vào thành mạch (đầu gần hoặc đầu xa).
+ Endoleak type II là loại thường gặp nhất và là kết quả của áp lực kéo dài (persistent pressurization) của túi phình động mạch (aneurysm sac) do dòng chảy ngược dòng (retrograde flow) từ các nhánh mạch máu bên của động mạch chủ, thường là động mạch mạc treo tràng dưới (inferior mesenteric artery) hoặc động mạch cho vùng thắt lưng (lumbar artery).
+ Endoleak type III xảy ra khi rò rỉ máu qua các chỗ khiếm khuyết của stent graft, do tách rời các thành phần cấu tạo hoặc do khiếm khuyết trong vật liệu stent graft.
+ Endoleak type IV là sự rò rỉ máu vô căn được phát hiện ngay sau khi đặt stent graft và tự giới hạn.
+ Endoleak type V, còn được gọi là endotension, là tình trạng giãn ra của túi phình động mạch mà không thấy được vị trí rò rỉ rõ ràng nào và có nguy cơ vỡ túi phình về lâu dài.
Hình. Phân loại endoleak (sơ đồ) (nguồn: Radiopaedia).
Hình. Phân loại endoleak (nguồn: Radiopaedia).
Hình 11. Rò động mạch chủ vào tá tràng (Aortoduodenal fistula) ở bệnh nhân nam 75 tuổi nhập khoa cấp cứu với tình trạng đi cầu phân đen (melena) sau 2 năm trải qua can thiệp sửa chữa stent nội mạch phình động mạch chủ bụng dưới thận với stent graft bị hỏng và gãy, cần phải chuyển sang can thiệp bằng ống ghép trong lòng mạch một bên từ động mạch chủ đến động mạch chậu bên phải (aorta–right iliac unilateral endoluminal graft) và bắc cầu động mạch đùi phải – động mạch đùi trái (right-to-left femoral-femoral bypass). Hình ảnh CT mặt phẳng axial (a, b) và sagittal (c) thu được bằng thuốc tương phản đường tĩnh mạch cho thấy gãy stent graft ban đầu (đầu mũi tên trong b) và vỡ túi phình động mạch (rupture of an aneurysm sac) vào tá tràng (các mũi tên), một dấu hiệu được xác định trong lúc phẫu thuật. Endoleak type II cũng hiện diện.
Hình 12. Endoleak type II không đáp ứng với điều trị thông thường (refractory) ở bệnh nhân nữ 84 tuổi đã trải qua sửa chữa nội mạch phình động mạch chủ bụng bị biến chứng do endoleak không đáp ứng với điều trị thông thường mặc dù đã thuyên tắc mạch bằng coil (coil embolization). (a, b) Hình ảnh CT mặt phẳng axial thu được bằng thuốc tương phản đường tĩnh mạch trước (a) và sau (b) thuyên tắc mạch bằng coil của endoleak type II cho thấy túi phình động mạch tiếp tục giãn ra. (c) Hình ảnh CT mặt phẳng axial cho thấy túi phình động mạch (aneurysm sac), cuối cùng đã vỡ. (d) Hình ảnh CT tái tạo thể tích (Volume-rendered CT ) cho thấy hình ảnh sau phẫu thuật của phình động mạch bị vỡ sau khi phẫu thuật sửa chữa mổ mở. Trường hợp này nhấn mạnh tầm quan trọng của việc tăng kích thước túi phình động mạch như một dấu hiệu dự báo về tình trạng không ổn định, bất kể có hình ảnh endoleak trên CT hay không.
Theo phân tích của Bernhard và cộng sự, 44 trong số 47 bệnh nhân có bằng chứng của endoleak liên quan đến vỡ phình động mạch, với nhiều endoleaks chỉ được xác định sau khi vỡ động mạch hoặc trong quá trình đánh giá hồi cứu. Điều thú vị là ba bệnh nhân không bị endoleak hoặc không tăng kích thước túi phình động mạch trước khi vỡ, điều này cho thấy việc không phát triển kích thước túi phình động mạch đã được loại bỏ (excluded aneurysm sac) không phải lúc nào cũng cho thấy tình trạng sửa chữa ổn định.
Các nghiên cứu gần đây hơn đã báo cáo tỷ lệ vỡ động mạch rất thấp sau sửa chữa phình động mạch qua can thiệp nội mạch (EVAR) theo tỷ lệ 2 bệnh nhân bị vỡ động mạch trong 1400 bệnh nhân-năm theo dõi và, trong nghiên cứu “Sửa chữa phình động mạch nội mạch ngẫu nhiên của Hà Lan” (DREAM – Dutch Randomized Endovascular Aneurysm Repair), không có trường hợp vỡ nào trong một nhóm bệnh nhân (cohort) trong 10 năm sau sửa chữa phình động mạch qua can thiệp nội mạch (EVAR). Một số tác giả cho rằng những tiến bộ trong công nghệ CT và sự sẵn có của MPR có thể giải thích một phần cho việc giảm tỷ lệ biến chứng vì chúng cho phép lựa chọn bệnh nhân sửa chữa phình động mạch qua can thiệp nội mạch (EVAR), phân tích hình thái và ước tính stent graft phù hợp hơn.
Người ta cũng đánh giá chung rằng sửa chữa phình động mạch qua can thiệp nội mạch (EVAR) được thực hiện trong “Hướng dẫn sử dụng – Instructions for Use” của tất cả các thiết bị có liên quan đến can thiệp thứ phát (secondary interventions) và tỷ lệ tử vong do động mạch chủ (aorta-based mortality) ít hơn, có thể là do cổ của động mạch chủ (aortic neck) dài hơn trong tiêu chuẩn hướng dẫn sử dụng, giúp cố định thiết bị ổn định hơn.
Phẫu thuật dùng ống ghép (Surgical grafts) ít có khả năng bị vỡ hơn. Một loạt so sánh gồm 1252 bệnh nhân đã trải qua đặt stent graft nội mạch và phẫu thuật dùng ống ghép và được theo dõi trong vòng 10 năm đã báo cáo rằng bệnh nhân chỉ bị vỡ động mạch sau khi điều trị can thiệp nội mạch. Đáng lưu ý, sự giãn ra hình thoi tiến triển (progressive fusiform dilatation) của phẫu thuật dùng ống ghép là một dấu hiệu dự báo và không cho thấy tình trạng ống ghép bị suy yếu, vì ống ghép mất dần độ mạnh (strength) theo thời gian. Tốc độ giãn ra thay đổi tùy thuộc vào vật liệu ống ghép (graft material), thường là polytetrafluoroethylene (ePTFE), polyester hoặc Dacron.
Vào 6 năm sau khi phẫu thuật mổ mở, tỷ lệ giãn ra dao động từ 20% đến 30% so với ban đầu, với các ống ghép ePTFE cho thấy ít giãn ra hơn, nhưng cũng ít uốn nắn hơn so với các ống ghép polyester trong quá trình cấy ghép (implantation). Tỷ lệ thoái hóa của ống ghép polyester sau phẫu thuật được báo cáo là 31.4% sau 10 năm và 100% sau 25–39 năm. Do đó, nguy cơ bị hỏng ống ghép cao hơn theo thời gian tăng lên tính từ khi đặt ống ghép. Sự hình thành giả phình động mạch tại chỗ nối mạch máu (nghĩa là vỡ động mạch được bao bọc lại (contained rupture)) xảy ra ở 0.2%–15% các ống ghép phẫu thuật. Ở những bệnh nhân bị phình động mạch đã phẫu thuật sửa chữa nhiều năm, cần kiểm tra các ống ghép để xem có thay đổi về hình dạng theo thời gian, tình trạng mà cho thấy sự không ổn định so với sự giãn ra hình thoi dự kiến hay không (Hình 13).
Hình 13. Vỡ ống ghép (Graft rupture) ở bệnh nhân nữ 80 tuổi có tiền sử bệnh lý động mạch ngoại biên nặng đã trải qua phẫu thuật bắc cầu động mạch chủ – đùi hai bên (aortobifemoral bypass) bằng ống ghép tổng hợp (synthetic graft) để điều trị bệnh lý tắc nghẽn động mạch cách đây hơn 25 năm. (a, b) Hình ảnh CT mặt phẳng axial thu được bằng thuốc tương phản đường tĩnh mạch cho thấy sự tiếp giáp của ống ghép động mạch chủ với cơ thắt lưng trái (mũi tên), một đặc điểm hình ảnh tương tự như dấu hiệu động mạch chủ che phủ, cho thấy sự không ổn định ở động mạch chủ tự nhiên (native aorta) của bệnh nhân. Bức tranh lâm sàng trở nên phức tạp do có đau lưng vùng thấp mạn tính, hậu quả của hẹp ống sống và cố định cột sống. (c) Hình ảnh CT mặt phẳng axial thu được 19 tháng sau cho thấy vỡ ống ghép cấp đột ngột được bao bọc lại và tụ máu lớn sau phúc mạc, cần phải sửa chữa nội mạch.
Tóm tắt
Chẩn đoán, theo dõi và quản lý điều trị phình động mạch chủ bụng phụ thuộc vào chụp MDCT có tiêm thuốc tương phản đường tĩnh mạch chất lượng cao với tái tạo đa mặt phẳng (MPR). Phình động mạch nên được đánh giá kỹ lưỡng để tìm các chỉ số CT về tình trạng không ổn định, bao gồm tình trạng ly giải mảng huyết khối (plaque lysis), dấu hiệu hình liềm tăng đậm độ, tụ máu quanh động mạch chủ, phình dạng túi mới xuất hiện hoặc dịch chuyển khu trú mảng nội mạc bị vôi hóa và dấu hiệu động mạch chủ che phủ.
Sau khi sửa chữa phình động mạch bằng can thiệp nội mạch hoặc mổ mở, endoleak không đáp ứng với điều trị thông thường, suy yếu ống ghép và giả phình động mạch tại chỗ nối động mạch cũng có thể báo hiệu nguy cơ vỡ. Vì CT là phương thức chính để chụp nối tiếp phình động mạch và thường được sử dụng để đánh giá đau bụng trong trường hợp cấp cứu, nên các bác sĩ chẩn đoán hình ảnh phải quen thuộc với các chỉ số CT về tình trạng không ổn định của phình động mạch để đẩy nhanh quá trình điều trị phẫu thuật và có khả năng ngăn ngừa vỡ phình động mạch.
Tài liệu tham khảo
Người dịch: Bs. Lê Thị Ny Ny – Anhvanyds
Để lại một phản hồi Hủy