Định nghĩa, phổ bệnh và tần suất
Thân chung động mạch (CAT) đặc trưng bởi thân động mạch duy nhất xuất phát từ đáy tim và có nguồn gốc tuần hoàn hệ thống, tuần hoàn vành, và phổi (Hình 26.1). Thông liên thất lớn luôn hiện diện trong bất thường này, kết quả là gần như không có vách liên thất phần phễu (1). CAT là do thất bại sự phình thân chung, bình thường trong quá trình phôi thân chung động mạch phân chia thành động mạch chủ và động mạch phổi, làm dính lại, kết quả là tồn tại thân chung (2). Phổ của bệnh lý này rộng và chủ yếu liên quan đến nguồn gốc giải phẫu của động mạch phổi phải và động mạch phổi trái, các động mạch này có thể xuất phát từ một thân động động mạch phổi (Hình. 26.1A,B) hoặc các nhánh trực tiếp từ CAT hoặc động mạch chủ xuống. CAT được phân loại thành 4 type bởi Collett và Edwards, dựa trên nguồn gốc giải phẫu của các động mạch phổi (3). Ở type 1, một thân động mạch phổi ngắn xuất phát từ CAT và chia thành động mạch phổi phải và động mạch phổi trái (Hình. 26.1A). Ở type 2 và 3, cả 2 động mạch phổi đều xuất phát riêng, như các nhánh riêng lẻ, từ CAT và chúng gần nhau về mặt giải phẫu (type 2) hoặc xa nhau (type 3). Ở type 4, hiện tại chúng được phân loại lại như teo van động mạch phổi kèm VSD (xem Chương 25) hơn là CAT, các động mạch phổi xuất phát từ cung động mạch chủ hoặc động mạch chủ xuống. Phân loại khác từ type A1 đến A4 được Van Praagh đề xuất (4). Trong phân loại này, type 1 tương tự như type 1 của phân loại Collett và Edward’s, type A2 kết hợp type 2 và 3, type A3 mô tả một động mạch phổi đơn độc có nguồn gốc từ CAT với tuần hoàn ống động mạch hoặc tuần hoàn phụ thêm cung cấp cho phổi đối bên, và type A4 đề cập đến bất thường cung động mạch chủ, bao gồm các gián đoạn hoàn toàn (Hình 26.1B). Gốc của CAT lớn và nguồn gốc 2 thất trong hầu hết các trường hợp (cưỡi ngựa trên thông liên thất). Tuy nhiên, có đến 1/3 các trường hợp có gốc CAT dường như xuất phát hoàn toàn từ thất phải, và trong những trường hợp hiếp gặp, gốc CAT xuất phát hoàn toàn từ thất trái. Van CAT có 3 lá (tricuspid) trong khoảng 69% các trường hợp, 4 lá van (quadricuspid) trong khoảng 22% trường hợp, 2 lá (bicuspid) trong 9% trường hợp, và thỉnh thoảng hiếm khi một, năm, hoặc nhiều lá hơn (5). 2 type thường được chẩn đoán nhất ở thai kì là type 1/type A1 và type A4. Hình 26.2 trình bày giải phẫu tử thi của CAT type 1.
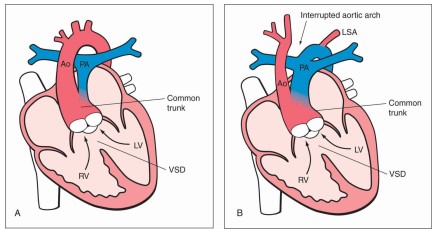
Hình 26.1: Sơ đồ hình vẽ của thân chung động mạch (CAT) type 1 (A) và type A4 (B). Xem bài viết để có chi tiết. LV, thất trái; RV, thất phải; PA, động mạch phổi; Ao, động mạch chủ; LSA, động mạch dưới đòn trái, VSD, thông liên thất.
Hình 26.2: Giải phẫu tử thi của thân chung động mạch type 1 (so sánh với Hình 26.1A). Thân chung (mũi tên) mở thấy loạn sản van thân chung và chia đôi thành động mạch phổi (PA) và động mạch chủ (AO). Ống động mạch không thấy và cung động mạch chủ bên phải được ghi nhận. Dấu sao trình bày thông liên thất. RV, thất phải; LV, thất trái.
CAT gặp khoảng 1.6% ở tất cả trẻ sơ sinh mắc bệnh tim bẩm sinh (6), được báo cáo xuất hiện trong khoảng 1.07/10,000 trẻ sinh ra (7), và thường gặp ở trẻ sơ sinh có mẹ bị đái tháo đường (8). CAT xuất hiện cân bằng ở nam và nữ và tần suất thường gặp hơn trong các nghiên cứu thai nhi (9). Thường liên quan đến bất thường nhiễm sắc thể, chủ yếu là mất đoạn 22q11.
Các dấu hiệu siêu âm
Trắng đen
Mặt cắt 4 buồng tim thường bình thường trong CAT (Hình 26.3 và 26.4) trừ khi VSD lớn và có thể thấy trên mặt cắt này, và tim xoay về phía bên trái hoặc cung đọng mạch chủ bên phải. Việc chẩn đoán được phát hiện tốt nhất bởi thông liên thất quanh màng kèm một mạch máu lớn cưỡi ngựa trên mặt cắt 5 buồng (Hình 26.4B) và không thấy động mạch phổi phân chia và lá van xuất phát từ thất phải. Xác nhận chuẩn đoán luôn được thực hiện bằng cách xác định thân động mạch phổi (hoặc các động mạch) xuất phát trực tiếp từ mạch máu lớn cưỡi ngựa (Hình 26.3B, và 26.5). Trên mặt cắt 5 buồng, gốc của CAT lớn và các lá van dày (loạn sản) kèm vận động không chính xác (Hình 26.5). Mặt cắt trục ngắn có thể thấy các lá van bất thường (Hình 26.6). Việc xác định động mạch phổi chính ngắn trên mặt cắt 5 buồng xuất phát từ thân chung lớn và đi về phía bên trái xác nhận chẩn đoán CAT (type 1) và phân biệt bất thường này với tứ chứng Fallot. Trong CAT type 1, động mạch chủ lớn và động mạch phổi hẹp. Trong CAT type 2 và 3, không có thân động mạch phổi, và các động mạch phổi xuất phát từ phía sau hoặc mặt bên thân chung. Chẩn đoán phân biệt tiền sản các type CAT thường khó và không khả thi, đặc biệt trong tam cá nguyệt thứ 2 (11). Tuy nhiên chẩn đoán phân biệt CAT type 4 với gián đoạn cung động mạch chủ có thể được bằng cách đánh giá kích thước (Hình 26.4) và đường đi của các động mạch lớn. Mặt cắt 3 mạch máu-khí quản rất hữu ích trong chẩn đoán vì mặt cắt này giúp thấy được một mạch máu dãn lớn, đại diện cho cung động mạch chủ, vì ống động mạch không phát triển trong hơn 50% các trường hợp (Hình 26.7) (9) và mất liên tục eo động mạch chủ khi có gián đoạn cung động mạch chủ. Trong 70% các trường hợp, cung động mạch chủ trên mặt cắt 3 mạch máu – khí quản sẽ ở bên trái khí quản và 30% bên phải khí quản, biểu hiện cho cung động mạch chủ bên phải. Tuyến ức cũng thấy được ở mặt cắt 3 mạch máu-khí quản nằm giữa đoạn ngang cung động chủ và thành ngực trước, nó thường nhỏ và không thấy trong khoảng 1/3 các trường hợp, đây là dấu hiệu có thể liên quan đến mất đoạn nhỏ 22q11 (Hình 26.7) (10, 12, 13).
Hình 26.3: Mặt cắt 4 buồng (A) và mặt cắt 5 buồng (B) của thai nhi mắc thân chung động mạch (CAT). Ghi nhận mặt cắt 4 buồng bình thường ở hình A. Ở hình B, CAT (mũi tên) được trình bày, xuất phát của động mạch chủ (AO) và động mạch phổi (PA). Động mạch phổi hẹp ở hình B nghi ngờ có CAT type 1. LA, nhĩ trái; RA, nhĩ phải; LV, thất trái; RV, thất phải.
Hình 26.4: Mặt cắt ngang 4 buồng (A) và mặt cắt 5 buồng (B) của thai nhi bị thân chung động mạch (CAT). Ghi nhận mặt cắt 4 buồng tim bình thường ở hình A. Ở hình B, thấy thông liên thất (dấu sao) và CAT cưỡi ngựa lớn (mũi tên). Thất xuất phát của một động mạch chủ hẹp (AO) và một động mạch phổi lớn (PA), nghi ngờ CAT type A4 kèm gián đoạn cung động mạch chủ. LA, nhĩ trái; RA, nhĩ phải; LV, thất trái; RV, thất phải.
Hình 26.5: Mặt phẳng ngang mức mặt cắt 4 buồng thấy thân chung động mạch cưỡi ngựa lớn, chia đôi thành động mạch phổi (PA) và động mạch chủ (AO). Lưu ý dày và loạn sản van của thân chung. VSD, thông liên thất, L, trái.
Hình 26.6: Mặt cắt trục ngắn qua van thân chung chứng minh hiện diện 4 lá van (đánh số 1 -4).
Hình 26.7: Mặt cắt 3 mạch máu khí quản ở thai nhi bị thân chung động mạch. Ghi nhận động mạch phổi (PA) nhỏ và cung động mạch chủ lớn (AO). Tuyến ức bị thiểu sản đươc xem như một phần của mất đoạn nhỏ nhiễm sắc thể 22q11 ở thai nhi này. SVC, tĩnh mạch chủ trên; Tr, khí quản; L, trái.
Hình 26.8: 2D (A) và Doppler màu (B) của một trường hợp thân chung động mạch ở mặt cắt 5 buồng. Hình A trình bày một thân chung động mạch lớn chia đôi thành động mạch phổi (PA) và động mạch chủ (AO). Hình B thấy aliasing màu tại van. RV, thất phải; LV, thất trái.
Doppler màu
Doppler màu có thể hữu ích nhưng không cần thiết để chẩn đoán CAT. Tuy nhiên, Doppler màu giúp chứng minh shunt qua VSD và dòng chảy vận tốc cao với aliasing màu qua CAT cưỡi ngựa (Hình. 26.8). Loạn sản van của thân chung là một dấu hiệu phổ biến trong bất thường này, hở van thân chung trong thì tâm trương thường được thấy trên Doppler màu (Hình 26.9 đến 26.12). Đôi khi, loạn sản van thân chung gây hẹp và thấy dòng chảy xoáy xuôi dòng rõ (Hình 26.10). Ở CAT type 2 và 3, Doppler màu giúp xác định nguồn gốc và đường đi của động mạch phổi phải và động mạch phổi trái.
Hình 26.9: Doppler màu thai nhi bị thân chung động mạch (CAT) trên mặt cắt 4 buồng từ mỏm với loạn sản van điển hình. Hình A thấy dòng chảy trong thì tâm trương (A) vào động mạch chủ (AO) và động mạch phổi (PA) (màu xanh). Hình B, hở van CAT (màu đỏ) vào thất phải (RV) được ghi nhận trong thì tâm trương. Sự hiện diện hở van CAT do loạn sản bẩm sinh lá van. So sánh với các Hình 26.10 đến 26.12. LV, thất trái.
Hình 26.10: Doppler màu và phổ Doppler qua van thân chung động mạch (CAT). Hình A thấy dòng chảy Doppler màu vào CAT trong thì tâm thu (màu xanh). Hình B thấy hở nặng trên Doppler màu trong thì tâm trương (màu đỏ). Hình C thấy hở van nặng toàn thì tâm trương trên phổ Doppler (mũi tên) kèm hẹp van (vận tốc đỉnh > 100cm/s). LV, thất trái; RV, thất phải.
Hình 26.11: Hình ảnh trắng đen (A) và Doppler màu kèm phổ (B) trên mặt cắt 5 buồng của một thai nhi bị thân chung động mạch (CAT) với loạn sản lá van (giống như thai Hình 26.4). Hình A thấy dày các lá van (mũi tên). Hình B chứng minh hở van toàn thì tâm trương mức độ nặng trên Doppler màu (màu đỏ) và phổ Doppler trong thì tâm trương. So sánh với Hình 26.10.
Hình 26.12: Doppler màu và phổ Doppler của mặt cắt 5 buồng ở thai nhi bị thân chung động mạch (CAT) kèm loạn sản các lá van ở tuổi nhi 16 tuần tuổi. Lưu ý sự hiện diện dòng chảy xuôi dòng (A) vào thân chung cưỡi ngựa (màu xanh) và dòng hở (màu đỏ) từ cả thất phải (RV) và thất trái (LV). Aliasing màu cũng thấy được trong thân chung ở hình A và B. Hình C xác nhận hiện diện hở van nặng trên phổ Doppler.
Thai sớm
Có thể chẩn đoán CAT trong ở tuổi thai cuối tam cá nguyệt 1 và đầu tam cá nguyệt 2 (14). Một dấu hiệu gợi ý bất thường thân nón ở tuổi thai sớm là lệch trục tim (15). Manh mối để chẩn đoán CAT ở tuổi thai sớm cũng bao gồm một mạch máu cưỡi ngựa dãn ở mặt cắt 5 buồng và một mạch máu lớn ở mặt cắt 3 mạch máu-khí quản (Hình 26.12 và 16.13). Doppler màu giúp ích trong chẩn đoán CAT ở tuổi thai sớm. Hở van thân chung (Hình 26.12) (nếu có) giúp chẩn đoán phân biệt CAT với các dị tật tim khác. Chứng minh nguồn gốc của thân động mạch phổi chính nhỏ thường khó ở tuổi thai sớm (9).
Siêu âm 3D
Hình ảnh siêu âm cắt lớp cho phép chứng minh các đặc điểm giải phẫu của CAT ở đồng thời các mặt phẳng khác nhau (16). Kết xuất và tái tạo ba chiều (3D), đặc biệt với Doppler màu, chế độ đảo ngược, hoặc B-flow, được thực hiện để giúp xác định CAT với chỗ chia đôi của nó (Hình 26.14 đến 16.16) và các nhánh động mạch phổi trong CAT type 2 và 3.
Cách bất thường tại tim và ngoài tim
Di tật liên quan tại tim thường gặp trong CAT. VSD hầu như luôn thấy và là một phần của dị tật tim này. Ống động mạch không thấy trong 50% các trường hợp, và khi hiện diện, nó vẫn tồn tại sau sinh trong khoảng 2/3 các trường hợp (17). Bất thường cung động mạch chủ thường gặp trong CAT, với cung động mạch chủ bên phải trong 21% đến 35% các trường hợp, gián đoạn cung động mạch chủ khoảng 15% các trường hợp, và hiếm khi thiểu sản cugn động mạch chủ hay tồn tại cung động mạch chủ đôi (9, 17-19). Không có một trong các động mạch phổi được mô tả lên tới 16% trong một nghiên cứu, với không có động mạch phổi phía bên cugn động mạch chủ (20). Biến thể về nguốn gốc của động mạch vành bất thường hơn 1/3 các trường hợp CAT, và thông tin này liên quan đến kế hoạch phẫu thuật (21). Thường liên quan đến loạn sản van thân chung kèm thiểu sản. Các bất thường tại tim khác hiếm gặp hơn và bao gồm kênh chung nhĩ thất (AVSD), tâm thất duy nhất, và teo van 3 lá kèm VSD, trong những dị tật khác.
Các dị tật cấu trúc ngoài tim được gặp lên tới 40% các trường hợp CAT và thường không đặc hiệu (10). Bất thường NST cũng phổ biến, và NST đồ thai nhi nên được thực hiện sau khi chẩn đoán CAT. Bất thường số lượng NST thấy khoảng 4.5% các trường hợp, bao gồm trisomi 21, 18, và 13 và mất đoạn nhỏ 22q11 được báo cáo 30-40% các trường hợp (10, 12, 22). CAT và thất phải 2 đường ra là những bất thường tim thường gặp được báo cáo ở những bà mẹ mang thai bị đái tháo đường (8).
Hình 26.13: Thân chung động mạch (CAT) ở thai nhi 13 tuần tuổi. Ghi nhân ở hình A và B, sự chia đôi của CAT thành động mạch chủ (AO) và động mạch phổi (PA). Cũng ghi nhận rằng đường đi cung động mạch chủ bên phải khí quản. R, phải; L, trái.
Hình 26.14: Mặt phẳng tái lập trên Doppler năng lượng ghi nhận được từ khối 3D ở thai nhi mắc thân chung động mạch (CAT) type 1, chứng minh sự chia đôi của thân chung thành động mạch chủ (AO) và động mạch phổi chính (PA). PA phân chia thành động mạch phổi phải (rpa) và động mạch phổi trái (lpa).
Hình 26.15: Thân chung động mạch (CAT, mũi tên) type 1, trinh bày trong một khối 3D về chế độ đảo ngược (Inversion mode). Ghi nhận sự chia đôi thành động mạch chủ (AO) và động mạch phổi (PA). So sánh với Hình 26.1A và 26.3. LV, thất trái; RV, thất phải.
Chẩn đoán phân biệt
Hai dị tật tim nên được đề cập trong chẩn đoán phân biệt của CAT là tứ chứng Fallot và teo van động mạch phổi kèm thông liên thất – vì cả hai đều liên quan đến VSD và động mạch chủ cưỡi ngựa. Doppler màu giúp phân biệt chính xác giữa các tổn thương này của thai. Chứng minh nguồn gốc chung của động mạch phổi và động mạch chủ từ một thân chung động mạch lớn là rất quan trọng để chẩn đoán chính xác CAT. Một trong những dấu hiệu dễ thấy là chứng minh lá van loạn sản kèm suy van, thường là CAT và không phải tứ chứng FAllot hoặc các tình trạng khác. Bảng 26.1 tổng hợp các đặc điểm phân biệt chính giữa CAT và tứ chứng Fallot, và Bảng 25.1 và 25.3 phát họa các đặc điểm phân biệt khác. Chẩn đoán nhầm CAT thành tứ chứng Fallot hoặc teo van động mạch phổi kèm VSD thường ít xảy ra.
Hình 26.16: Thân chung động mạch (CAT, mũi tên trong) type A4 kèm gián đoạn cung động mạch chủ, được trình bày khối 3D với chế độ đảo ngược. Chú ý phân chia của CAT vào động mạch phổi (PA) và động mạch chủ (AO). Ống động mạch (DA) có nhưng động mạch mạch chủ xuống nhỏ và gián đoạn. (Đường đi của các mạch máu cánh tay tam dầu nhỏ không thấy trên hình này). So sánh với Hình 26.1B, LV, thất trái; RV, thất phải.
| Bảng 26.1 | Các đặc điểm phân biệt thân chung động mạch (CAT) type 1 và tứ chứng Fallot với hẹp động mạch phổi | |
| CAT type 1 | TOF với hẹp động mạch phổi | |
| Thông liên thất Malaligned và động mạch chủ cưỡi ngựa | Có | Có |
| Kích thước gốc động mạch chủ | dãn lớn | Bình thường đến dãn |
| Thân động mạch phổi | Xuất phát từ thân chung động mạch.
Không có thân động mạch phổi đi từ tâm thất |
Hẹp, xuất phát riêng lẻ từ tâm thất với tồn tại van động mạch phổi |
| Ống động mạch | Không có > 50% | Hẹp, dòng chảy xuôi dòng |
| Van động mạch chủ/thân chung | Van với 1-6 lá
Thường loạn sản và suy van |
Van động mạch chủ bình thường
Không có dòng hở |
| Sai lệch NST | Mất đoạn 22q11 khoảng 30-40%
Trisomi khoảng 4-5% |
Mất đoạn 22q11 khoảng 10-15%
Trisomi khoảng 30% |
| Tiên lượng trong cá trường hợp đơn độc sau sinh | Tốt
Cần phẫu thuật lại đường dẫn động mạch phổi |
Tốt đến rất tốt |
Tiên lượng và kết cục
Theo dõi tiền sản các thai nhi mắc CAT là quan trọng, đặc biệt khi tổn thương bị biến chứng hẹp và suy van thân chung hoặc các bất thường tại tim khác làm tăng nguy cơ suy tim, phù thai, hoặc thai lưu. Dữ liệu từ 3 nghiên cứu loạt ca, đươc tổng hợp ở Bảng 26.2, bao gồm tổng 86 thai nhi mắc CAT, thấy chấm dứt thai kì khoảng 37%, tỉ lệ sống sót được hiệu chỉnh sau khi loại trừ các trường hợp chấm dứt thai kì và chết trong tử cung là 58%, và tỉ lệ sống sót chung là 32%, thấp hơn nhiều so với các nghiên cứu ở trẻ em được báo cáo (9, 10, 24). Chẩn đoán tiền sản CAT liên quan đến tỉ lệ cao chấm dứt thai kì có chọn lọc. Chẩn đoán thai nhi có liên quan đến thời điểm sửa chữa ở tuổi thai nhỏ hơn nhưng không thấy cải thiện tỷ lệ sống sót chung ở trẻ nhũ nhi (24).
Khả năng sống sót đến tuổi vị thành niên hiếm gặp nếu không có phẫu thuật sửa chữa (3), và tiên lượng trẻ sơ sinh có liên quan đến sự hiện diện của các bất thường liên quan. Phẫu thuật sửa chữa hoàn toàn thường được ưu tiên lựa chọn điều trị trong 8 tuần đầu sau sinh. Phẫu thuật bao gồm 3 phần: đóng VSD, tách động mạch phổi từ thân chung, và nối động mạch phổi vào tâm thất phải với một đường dẫn. Thông thường, các phẫu thuật muộn hơn đòi hỏi thay thế ống động mạch phổi nguyên phát do kém phát triển cùng với tuổi. Trong một nghiên cứu bao gồm 50 trẻ nhũ nhi CAT được phẫu thuật từ 2 đến 6 ngày tuổi, tỉ lệ sống sót đến 3 tuổi được báo cáo là 96% (26). Không có trường hợp tử vong nào ở những bệnh nhân có liên quan đến cung động mạch chủ gián đoạn và 2 trường hợp tử vong ở những bệnh nhân có hở van thân chung, cả 2 đều không được sửa chửa (26). Thay thế ống động mạch được thực hiện ở 17 bệnh nhân (34%) sau thời gian trung bình 2 năm (26).Trong nghiên cứu này, các yếu tố nguy cơ kinh điển là cung động mạch chủ bị gián đoạn và hở van thân chung không ảnh hưởng đến kết quả chung (26). Một nghiên cứu gần đây hơn bao gồm 25 bệnh nhân bị CAT với tuổi trung bình khoảng 12 tuổi thấy tỷ lệ tái can thiệp kết hợp catheter và phẫu thuật là 52% trên ống dẫn và 56% trên động mạch phổi (27). Suy van thân chung mức độ trung bình hoặc nặng thấy 11% các trường hợp, và thay thế van thân chung ở 8% các trường hợp (27). Nghiên cứu này chứng minh bệnh lý đi kèm nhiều trong suốt thời thơ ấu, gánh nặng đáng kể của việc tái can thiệp phẫu thuật và đặt catheter, và sự thiếu hoạt động thể lực, các tình trạng chức năng, và sức khỏe liên quan đến chất lượng cuộc sống ở những trẻ em CAT và thanh thiếu niên (28).
Bảng 26.2 Kết quả của nghiên cứu loạt ca thai nhi với thân chung động mạch
| Dữ liệu tổng hợp | |
| Tổng trường hợp | 87 |
| Chấm dứt thai kì (%) | 34 (89%) |
| Chết trong tử cung (%) | 4(4.5%) |
| Sinh sống (%) | 48 (55%) |
| Tử vong ở trẻ sơ sinh và nhũ nhi (%) | 20 (23%) |
| Sống sót trong tất cả trường hợp (%) | 28 (32%) |
| Sống sót trong các trường hợp tiếp tục thai kì (%) | 28/52 (53%) |
| Sống sót trong tất cả trẻ sinh sống (%) | 28/48 (58%) |
“Dữ liệu được tổng hợp từ Sharland GK. Common arterial trunk. Trong: L Allan, ed. Textbook of Fetal Cardiology. London:Greenwich Media; 2000;288–303; Volpe P, Paladini D, Marasini
M, et al. Common arterial trunk in the fetus: characteristics, associations, and outcome in a
multicentre series of 23 cases. Heart. 2003;89(12):1437–1441; and Swanson TM, Selamet
Tierney ES, Tworetzky W, et al. Truncus arteriosus: diagnostic accuracy, outcomes, and impact
of prenatal diagnosis. Pediatr Cardiol. 2009;30:256–261.”
| Các đặc điểm chính: Thân chung động mạch |
|
Được dịch từ sách: A practical Guide to Fetal Echocardiography: Normal and Abnormal Hearts 3E.
Biên dịch: Bs Đặng Xuân Kỳ
Cách bạn có thể tham khảo thêm về siêu âm thai tại trang web: https://sieuamthai.xyz/
Mọi góp ý xin liên hệ: xuanky.dang@gmail.com.
Tài liệu tham khảo
1. Cabalka AK, Edwards WD, Dearani JA. Truncus arteriosus. In: Allen HD, Driscoll DJ,
Shaddy RE, et al, eds. Moss and Adams’ Heart Disease in Infants, Children, and
Adolescents. 8th ed. Baltimore, MD: Williams & Wilkins; 2012:990–1002.
2. Van Mierop LH, Patterson DF, Schnarr WR. Pathogenesis of persistent truncus arteriosus in
light of observations made in a dog embryo with the anomaly. Am J Cardiol. 1978;41:755–
762.
3. Collett RW, Edwards JE. Persistent truncus arteriosus; a classification according to anatomic
types. Surg Clin North Am. 1949;29:1245–1270.
4. Van Praagh R, Van Praagh S. The anatomy of common aorticopulmonary trunk (truncus
arteriosus communis) and its embryologic implications. A study of 57 necropsy cases. Am J
Cardiol. 1965;16:406–425.
5. Fuglestad SJ, Puga FJ, Danielson GK, et al. Surgical pathology of the truncal valve: a study
of 12 cases. Am J Cardiovasc Pathol. 1988;2:39–47.
6. Ferencz C, Rubin JD, Loffredo CA, et al. Epidemiology of Congenital Heart Disease. The
Baltimore-Washington Infant Study, 1981–1989. Perspectives in Pediatric Cardiology.
Mount Kisco, NY: Futura Publishing; 1993.
7. Hoffman JI, Kaplan S. The incidence of congenital heart disease. J Am Coll Cardiol.
2002;39:1890–1900.
8. Ferencz C, Rubin JD, McCarter RJ, et al. Maternal diabetes and cardiovascular
malformations: predominance of double outlet right ventricle and truncus arteriosus.
Teratology. 1990;41:319–326.
9. Sharland G. Common arterial trunk. In: Allan LD, Hornberger LK, Sharland GK, eds.
Textbook of Fetal Cardiology. London, England: Greenwich Medical Media; 2000:288–303.
10. Volpe P, Paladini D, Marasini M, et al. Common arterial trunk in the fetus: characteristics,
associations, and outcome in a multicentre series of 23 cases. Heart. 2003;89:1437–1441.
11. Muhler MR, Rake A, Schwabe M, et al. Truncus arteriosus communis in a midtrimester fetus: comparison of prenatal ultrasound and MRI with postmortem MRI and autopsy. Eur Radiol. 2004;14:2120–2124.
12. Chaoui R, Kalache KD, Heling KS, et al. Absent or hypoplastic thymus on ultrasound: a
marker for deletion 22q11.2 in fetal cardiac defects. Ultrasound Obstet Gynecol.
2002;20:546–552.
13. Machlitt A, Tennstedt C, Korner H, et al. Prenatal diagnosis of 22q11 microdeletion in an
early second-trimester fetus with conotruncal anomaly presenting with increased nuchal
translucency and bilateral intracardiac echogenic foci. Ultrasound Obstet Gynecol.
2002;19:510–513.
14. Achiron R, Weissman A, Rotstein Z, et al. Transvaginal echocardiographic examination of the fetal heart between 13 and 15 weeks’ gestation in a low-risk population. J Ultrasound Med.
1994;13:783–789.
15. Sinkovskaya E, Chaoui R, Karl K, et al. Fetal cardiac axis and congenital heart defects in
early gestation: a multicenter study. Obstet Gynecol. 2015;125:453–460.
16. Paladini D, Vassallo M, Sglavo G, et al. The role of spatio-temporal image correlation
(STIC) with tomographic ultrasound imaging (TUI) in the sequential analysis of fetal
congenital heart disease. Ultrasound Obstet Gynecol. 2006;27:555–561.
17. Butto F, Lucas RV Jr, Edwards JE. Persistent truncus arteriosus: pathologic anatomy in 54
cases. Pediatr Cardiol. 1986;7:95–101.
18. Marcelletti C, McGoon DC, Danielson GK, et al. Early and late results of surgical repair of
truncus arteriosus. Circulation. 1977;55:636–641.
19. Nath PH, Zollikofer C, Castaneda-Zuniga W, et al. Persistent truncus arteriosis associated
with interruption of the aortic arch. Br J Radiol. 1980;53:853–859.
20. Mair DD, Ritter DG, Davis GD, et al. Selection of patients with truncus arteriosus for
surgical correction; anatomic and hemodynamic considerations. Circulation. 1974;49:144–
151.
21. Shrivastava S, Edwards JE. Coronary arterial origin in persistent truncus arteriosus.
Circulation. 1977;55:551–554.
22. Boudjemline Y, Fermont L, Le Bidois J, et al. Prevalence of 22q11 deletion in fetuses with
conotruncal cardiac defects: a 6-year prospective study. J Pediatr. 2001;138:520–524.
23. Sivanandam S, Glickstein JS, Printz BF, et al. Prenatal diagnosis of conotruncal
malformations: diagnostic accuracy, outcome, chromosomal abnormalities, and extracardiac
anomalies. Am J Perinatol. 2006;23:241–245.
24. Swanson TM, Selamet Tierney ES, Tworetzky W, et al. Truncus arteriosus: diagnostic
accuracy, outcomes, and impact of prenatal diagnosis. Pediatr Cardiol. 2009;30:256–261.
25. Tometzki AJ, Suda K, Kohl T, et al. Accuracy of prenatal echocardiographic diagnosis and
prognosis of fetuses with conotruncal anomalies. J Am Coll Cardiol. 1999;33:1696–1701.
26. Jahangiri M, Zurakowski D, Mayer JE, et al. Repair of the truncal valve and associated
interrupted arch in neonates with truncus arteriosus. J Thorac Cardiovasc Surg.
2000;119:508–514.
27. Williams JM, de Leeuw M, Black MD, et al. Factors associated with outcomes of persistent
truncus arteriosus. J Am Coll Cardiol. 1999;34:545–553.
28. O’Byrne ML, Mercer-Rosa L, Zhao H, et al. Morbidity in children and adolescents after
surgical correction of truncus arteriosus communis. Am Heart J. 2013;166:512–51
Để lại một phản hồi Hủy