Hình ảnh đóng vai trò quan trọng trong chẩn đoán, mô tả đặc điểm và điều trị các bệnh lý nhiễm trùng gan. Trong thực hành lâm sàng, vai trò chính của hình ảnh là phát hiện sớm bệnh lý, loại trừ các tổn thương khác có biểu hiện tương tự, đưa ra chẩn đoán xác định (definitive diagnosis) khi có các dấu hiệu điển hình (classsic finding) và hướng dẫn điều trị chống lại vi sinh vật (antimicrobial), can thiệp (interventional) hoặc phẫu thuật (surgical) thích hợp.
Các đặc điểm hình ảnh thường gặp nhất của nhiễm trùng ở gan (hepatic infections) do vi khuẩn (bacterial), vi-rút (viral), ký sinh trùng (parasitic) và nấm (fungal) được mô tả, và các biểu hiện lâm sàng và hình ảnh chính được xem xét có thể hữu ích để thu hẹp chẩn đoán phân biệt và tránh những cạm bẫy (pitfalls) trong việc diễn giải hình ảnh. Siêu âm (Ultrasonography – US), chụp cắt lớp vi tính (computed tomography – CT) và chụp cộng hưởng từ (magnetic resonance imaging – MRI) cho phép phát hiện chính xác hầu hết các bệnh lý nhiễm trùng gan và trong một số trường hợp, có thể cung cấp các dấu hiệu đặc hiệu (specific signs) để xác định tác nhân gây bệnh tiềm ẩn và loại trừ các tổn thương khác có các đặc điểm hình ảnh tương tự.
Trong các bệnh nhiễm trùng do vi khuẩn và ký sinh trùng, các đặc điểm hình ảnh đặc hiệu có thể đủ để loại trừ khối u (neoplasm) và đôi khi, giúp xác định tác nhân gây nhiễm trùng tiềm ẩn. Siêu âm và CT là phương tiện quan trọng để hướng dẫn chọc hút (aspiration) hoặc dẫn lưu (drainage) qua da khi cần thiết. Trong các bệnh lý nhiễm trùng do vi-rút, hình ảnh rất quan trọng để loại trừ các bệnh lý có thể biểu hiện với dấu hiệu lâm sàng và xét nghiệm tương tự. Nhiễm trùng do nấm lan rộng (Disseminated fungal infections) cần được phát hiện sớm qua hình ảnh vì chúng có thể gây tử vong (fatal) nếu không được điều trị kịp thời. Hiểu biết về dịch tễ học (epidemiology), cơ chế bệnh sinh (pathogenesis), biểu hiện lâm sàng (clinical manifestations), đặc điểm hình ảnh (imaging features) và điều trị nhiễm trùng ở gan có thể hỗ trợ chẩn đoán hình ảnh và hướng dẫn chăm sóc bệnh nhân thích hợp.
Giới thiệu
Hình ảnh đóng vai trò quan trọng trong việc phát hiện sớm, mô tả đặc điểm và điều trị bệnh lý nhiễm trùng gan. Chẩn đoán và điều trị kịp thời là rất quan trọng, đặc biệt đối với nhiễm trùng sinh mủ và do nấm vì chúng có thể gây tử vong nếu không được điều trị sớm. Siêu âm (US), chụp cắt lớp vi tính (CT) và chụp cộng hưởng từ (MRI) cho phép phát hiện chính xác hầu hết các bệnh lý nhiễm trùng gan, đôi khi cung cấp manh mối để xác định tác nhân gây bệnh tiềm ẩn.
Tuy nhiên, các đặc điểm hình ảnh của nhiễm trùng ở gan có thể ít đặc hiệu hơn và các tình trạng khác như khối u, nang hoặc bệnh lý tự miễn có thể có các đặc điểm tương tự. Do đó, chẩn đoán chính xác và kịp thời đòi hỏi phải nhận ra các đặc điểm hình ảnh riêng biệt có thể được tạo ra bởi một số tác nhân gây bệnh nhất định và kết hợp chúng với thông tin lâm sàng và xét nghiệm thích hợp. Tuy nhiên, có thể khó phân biệt nhiễm trùng gan với các bệnh lý khác chỉ dựa trên dấu hiệu hình ảnh và đôi khi cần phải nuôi cấy từ mẫu mô (tissue sampling) hoặc chọc hút dịch để đưa ra chẩn đoán cuối cùng chính xác và hướng dẫn điều trị thuốc chống vi sinh vật đặc hiệu.
Trong bài viết này, chúng tôi mô tả những dấu hiệu hình ảnh thường gặp nhất của nhiễm trùng gan do vi khuẩn, vi-rút, ký sinh trùng và nấm, đồng thời xem xét các đặc điểm hình ảnh và lâm sàng quan trọng có thể giúp bác sĩ chẩn đoán hình ảnh thu hẹp chẩn đoán phân biệt và tránh những cạm bẫy trong quá trình diễn giải hình ảnh.
Nhiễm trùng do vi khuẩn (Bacterial Infections)
Nhiễm trùng do vi khuẩn ở gan có thể được phân loại thành 3 loại: (a) áp xe gan sinh mủ (pyogenic liver abscesses), (b) bệnh lý u hạt ở gan do vi khuẩn (ví dụ, bệnh lao ở gan và bệnh do Bartonella (bartonellosis)), và (c) viêm gan cấp do vi khuẩn. Viêm gan cấp do vi khuẩn rất hiếm gặp và thường không biểu hiện bất thường về hình ảnh hoặc các dấu hiệu không đặc hiệu.
Áp xe gan sinh mủ (Pyogenic liver abscesses)
Áp xe gan (Liver abscess) là loại áp xe tạng (visceral abscess) thường gặp nhất. Biểu hiện lâm sàng bao gồm nhiều triệu chứng, nhưng phổ biến nhất là sốt (70%–90% bệnh nhân) và đau bụng, thường ở hạ sườn phải (50%–75%). Cơ chế bệnh sinh của áp xe gan là do nhiều yếu tố; chúng có thể là hậu quả của viêm đường mật ngược dòng (ascending cholangitis), lây lan theo đường máu (hematogenous dissemination) từ nhiễm trùng đường tiêu hóa qua tĩnh mạch cửa hoặc nhiễm trùng huyết lan tỏa qua động mạch gan hoặc lây lan kế cận (contiguous spread). Một đường lây lan khác để vi khuẩn xâm nhập vào gan là đi vào trực tiếp (direct inoculation) thông qua chấn thương xuyên thấu (penetrating trauma) hoặc thủ thuật xâm lấn (ví dụ, dụng cụ trong đường mật, nút mạch hóa chất động mạch qua catheter (TACE), sinh thiết gan qua da, đốt bằng sóng cao tần qua da hoặc phẫu thuật vùng bụng).
Nhiều loại vi khuẩn đã được mô tả trong cơ chế bệnh sinh của áp xe sinh mủ, phản ánh sự khác nhau giữa các bệnh nhân và khu vực địa lý. Phần lớn các mẫu nuôi cấy từ dịch chọc hút ra đều dương tính, trong khi cấy máu chỉ dương tính ở 50% trường hợp. Hầu hết áp xe gan sinh mủ là do nhiều loại vi khuẩn (polymicrobial). Theo truyền thống, Escherichia coli được báo cáo là vi khuẩn được phân lập (isolated microbe) phổ biến nhất; tuy nhiên, dữ liệu gần đây cho thấy Klebsiella pneumoniae là tác nhân gây bệnh phổ biến nhất trong áp xe gan sinh mủ.
Điều trị áp xe gan sinh mủ bao gồm dẫn lưu dưới hướng dẫn của hình ảnh và liệu pháp kháng sinh. Có sự khác biệt đáng kể trong thực hành lâm sàng liên quan đến tổng thời gian dùng kháng sinh. Khuyến cáo nên tiếp tục điều trị kháng sinh trong ít nhất 4–6 tuần, nhưng thời gian tối ưu vẫn chưa rõ ràng. Mặc dù việc dẫn lưu áp xe đơn độc có đường kính ≤ 5 cm có thể thực hiện trong một số trường hợp, nhưng việc dẫn lưu này có thể không cải thiện kết cục so với chỉ điều trị bằng kháng sinh đơn thuần mà không cần dẫn lưu. Đối với ổ áp xe đơn độc có đường kính > 5 cm, việc dẫn lưu bằng catheter nên được xem xét và ưu tiên hơn chọc hút bằng kim, mặc dù một số được ưu tiên can thiệp bằng phẫu thuật. Chẩn đoán kịp thời và dẫn lưu dưới sự hướng dẫn của hình ảnh đã được báo cáo là làm giảm tỷ lệ tử vong từ 65% xuống còn 2%–12%.
Độ nhạy của siêu âm và CT trong chẩn đoán áp xe gan sinh mủ lần lượt là 85% và 97%. Trên siêu âm, các ổ áp xe nhỏ (microabscesses) (<2 cm) biểu hiện dưới dạng các nốt giảm âm (hypoechoic nodules) hoặc các vùng tăng âm biến dạng có giới hạn không rõ ở gan. Các ổ áp xe lớn (large abscesses) có thể là tổn thương dạng khối giảm âm (hypoechoic) hoặc tăng âm (hyperechoic) phụ thuộc vào độ hồi âm của vách ngăn dày và mảnh vụn (debris) bên trong. Vì khác nhau về độ hồi âm nên áp xe sinh mủ có thể giống với tổn thương dạng mô đặc (Hình 1). Áp xe gan chỉ do một tác nhân là Klebsiella pneumoniae có thể biểu hiện chủ yếu là dạng mô đặc trên siêu âm. Khả năng phân biệt áp xe với khối u trên siêu âm không tiêm thuốc tương phản (nonenhanced US) bị giới hạn so với CT hoặc MRI. Đặc điểm tăng âm phía sau tổn thương (Acoustic through-transmission) và không có tín hiệu Doppler bên trong của áp xe gan trên siêu âm có thể hỗ trợ loại trừ khối u đặc (Hình 1). Tuy nhiên, nếu khối u đặc có hoại tử nhiều, nó có thể không phân biệt được với áp xe trên siêu âm.
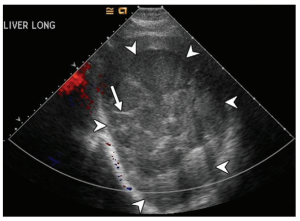
Hình 1. Áp xe gan do vi khuẩn (Bacterial hepatic abscess) ở bệnh nhân nữ 52 tuổi có biểu hiện sốt không rõ nguyên nhân (fever of unknown origin). Hình ảnh siêu âm Doppler màu mặt cắt dọc của gan cho thấy một khối tổn thương giảm âm (các đầu mũi tên) với các vùng tăng âm bên trong do vách ngăn (mũi tên) và mảnh vụn tạo ra. Ghi nhận không có tín hiệu Doppler bên trong. Phân tích bệnh học của mẫu bệnh phẩm sinh thiết gan đã xác nhận là áp xe do nhiều loại vi khuẩn (multimicrobial abscess).
Một số đặc điểm và dấu hiệu hình ảnh trên CT của áp xe gan đã được báo cáo trong y văn. Dấu hiệu thường gặp nhất trên CT có tiêm thuốc tương phản (contrast-enhanced CT) là tổn thương dạng khối tròn, giới hạn rõ (well-defined), có đậm độ thấp (low-attenuation) với viền bắt thuốc tương phản ở phía ngoại vi (enhancing peripheral rim). Áp xe có thể biểu hiện dưới nhiều dạng khác nhau: một ổ tụ dịch không phân vách bên trong (single nonloculated fluid collection), một khối dạng nang có nhiều vách bên trong (single multiloculated cystic mass), một khối đặc (solid process) (đám quánh (phlegmonous)), hoặc nhiều tổn thương đa ổ (multifocal lesions).
“Dấu hiệu bia bắn kép – double target sign” là một đặc điểm hình ảnh đặc trưng của áp xe gan được thấy trên hình ảnh CT có tiêm thuốc tương phản khi vùng chứa đầy dịch có đậm độ thấp ở trung tâm được bao quanh bởi một vòng trong cùng có đậm độ cao và một vòng ngoài cùng có đậm độ thấp. Lớp trong cùng (inner layer) bắt thuốc tương phản sớm và vẫn còn bắt thuốc ở thì muộn (delayed phases), trái ngược với lớp ngoài cùng (outer layer) có đậm độ thấp ở thì động mạch sớm và chỉ bắt thuốc tương phản ở thì muộn (Hình 2). Lớp trong cùng biểu thị cho màng sinh mủ (pyogenic membrane), và lớp ngoài cùng là do phù nề (edema) của nhu mô gan (hepatic parenchyma).
“Dấu hiệu tạo chùm – cluster sign” cũng là một đặc điểm hình ảnh của áp xe sinh mủ và xuất hiện khi nhiều tổn thương nhỏ có đậm độ thấp tập hợp lại tại một vùng khu trú và hợp nhất (coalesce) thành một ổ áp xe (abscess cavity) lớn hơn (Hình 2).
Hình 2. Áp xe gan sinh mủ ở bệnh nhân nữ 45 tuổi có biểu hiện sốt và đau ngực kiểu màng phổi (pleuritic chest pain). (a) Hình ảnh CT có tiêm thuốc tương phản chụp ở thì tĩnh mạch cửa (portal phase) trên mặt phẳng axial cho thấy một khối dạng nang có nhiều vách ngăn bên trong (multilocular cystic mass) ở phân thùy sau (posterior segment) của thùy gan phải (right hepatic lobe) kế cận với cơ hoành phải (right hemidiaphragm). Ghi nhận thành của tổn thương phân các lớp (“dấu hiệu bia bắn kép – double target sign”) với màng sinh mủ (pyogenic membrane) tăng bắt thuốc nằm bên trong (mũi tên) được bao quanh bởi nhu mô gan phù nề giảm đậm độ (đầu mũi tên). (b) Hình ảnh CT có tiêm thuốc tương phản chụp ở thì muộn (delayed phase) trên mặt phẳng axial cho thấy lớp trong cùng vẫn còn bắt thuốc kéo dài, lớp ngoài cùng bắt thuốc chậm hơn ở thì muộn (mũi tên) và sự hợp lưu của nhiều khoang nhỏ tạo ra “dấu hiệu tạo chùm – cluster sign”.
Một vùng phân thùy gan tăng bắt thuốc tương phản thoáng qua ở thì chụp sớm, dạng hình chêm (wedge-shaped) hoặc theo chu vi (circumferential) trên hình ảnh CT và MRI dynamic, và cân bằng (equilibrates) ở thì muộn, cũng được báo cáo là có liên quan đến áp xe gan. Sự khác biệt về đậm độ (attenuation) hoặc tín hiệu (signal intensity) thoáng qua này ở gan được cho là do thâm nhiễm tế bào viêm (inflammatory cell infiltration) và hẹp (stenosis) hoặc chèn ép (compression) các tĩnh mạch cửa nhỏ xung quanh ổ áp xe gan, có thể dẫn đến giảm lưu lượng máu qua tĩnh mạch cửa và tăng lưu lượng máu vào động mạch để bù trừ. Điều quan trọng là phải phân biệt áp xe gan có vùng phân thùy gan tăng bắt thuốc thoáng qua với u gan liên quan đến vùng phân thùy gan tăng bắt thuốc do hẹp hoặc tắc nghẽn tĩnh mạch cửa hoặc tĩnh mạch gan. Đánh giá cẩn thận tổn thương bằng hình ảnh CT và/hoặc MRI là điều cần thiết để phân biệt các loại tăng bắt thuốc gan thoáng qua này.
Trên hình ảnh MRI, áp xe gan thường cho thấy vùng trung tâm có tín hiệu thấp trên T1W và cao trên T2W, nhưng tín hiệu bên trong có thể thay đổi tùy thuộc vào thành phần protein. Dấu hiệu bia bắn kép (double target sign) biểu hiện trên hình ảnh T2W với lớp trong cùng đồng tín hiệu đến tín hiệu thấp và lớp ngoài cùng có tín hiệu cao (Hình 3a). Động học bắt thuốc tương phản (Dynamic contrast enhancement) của áp xe giống như trên CT, với lớp trong cùng bắt thuốc ở thì sớm và vẫn tiếp tục bắt thuốc ở thì muộn và phần ngoại vi bắt thuốc ở thì muộn (Hình 3b, 3c). Phù quanh tổn thương biểu hiện với tín hiệu cao trên T2W và có thể thấy ở 35% áp xe gan. Tín hiệu cao trên hình ảnh khuếch tán DWI (diffusion-weighted images) và tín hiệu thấp tương ứng trên bản đồ ADC thường được thấy.
Hình 3. Áp xe gan sinh mủ do viêm túi mật cấp hoại tử (acute gangrenous cholecystitis) ở bệnh nhân nam 65 tuổi. (a) MRI trên T2W mặt phẳng axial cho thấy dấu hiệu bia bắn kép (double target sign) của thành ổ áp xe, được thấy là lớp trong cùng đồng tín hiệu đến giảm tín hiệu (đầu mũi tên) và lớp ngoài cùng có tín hiệu cao vừa (mũi tên) bao quanh thành phần có tín hiệu cao bên trong ổ áp xe. Ghi nhận sỏi có tín hiệu thấp bị kẹt ở cổ túi mật (*). (b) MRI trên T1W xóa mỡ (FS) có tiêm thuốc tương phản ở thì động mạch mặt phẳng axial cho thấy bắt thuốc sớm ở lớp trong cùng (đầu mũi tên) và tình trạng sung huyết (hyperemia) theo vùng phân thùy của nhu mô gan kế cận. (c) MRI T1W có tiêm thuốc tương phản thì muộn mặt phẳng axial cho thấy sự bắt thuốc của lớp trong cùng và lớp ngoài cùng (mũi tên).
Khí (gas) có thể có trong 20% trường hợp áp xe gan, biểu hiện dưới dạng các bọt khí (bubbles) hoặc mức khí-dịch (air-fluid level), giúp chẩn đoán với độ tin cậy cao. Tuy nhiên, sự hình thành khí không do nhiễm trùng có thể được thấy ở các vùng gan hoại tử (liver necrosis), như sau khi đốt u gan và có thể là một cạm bẫy tiềm ẩn. Trên siêu âm, khí được thấy dưới dạng các ổ tăng âm (intense echogenic foci) với bóng lưng kiểu đa âm phản hồi ở phía sau (posterior acoustic reverberations and shadowing). Trên hình ảnh MRI, khí có thể biểu hiện dưới dạng các khoảng trống tín hiệu (signal voids) (tín hiệu đen) bên trong ổ áp xe, được thấy rõ hơn trên T1W gradient-echo với thời gian echo dài (hình ảnh in-phase) do sự nhạy từ của khí (Hình 4). Mức khí-dịch thường gặp hơn trong ổ áp xe do K.pneumoniae. Một đặc điểm hình ảnh bổ sung của nhiễm trùng do K.pneumoniae là “dấu hiệu màu ngọc lam – turquoise sign” do nhiều dải mỏng phân nhánh bên trong giống với khoáng chất màu ngọc lam (Hình 5).
Hình 4. Áp xe gan do vi khuẩn K.pneumoniae sản xuất b-lactamase phổ rộng ở bệnh nhân nam 55 tuổi, 1 năm sau khi ghép gan tại chỗ (orthotopic liver transplant). (a) Hình ảnh CT có tiêm thuốc tương phản mặt phẳng axial cho thấy khí bên trong ổ áp xe gan sinh mủ (mũi tên). (b) Hình ảnh MRI T1W gradient-echo opposed-phase mặt phẳng axial (thời gian echo, 2.2 mili giây) cho thấy tín hiệu trống (signal void) của khí bên trong ổ áp xe (mũi tên), tương tự như hình ảnh khí trong đại tràng (*). (c) Hình ảnh MRI T1W gradient-echo in-phase mặt phẳng axial (thời gian echo, 4.4 mili giây) cho thấy hiện tượng xảo ảnh nở hoa (blooming artifact) bên trong ổ áp xe do hiệu ứng tăng nhạy từ của khí (mũi tên). Hiện tượng xảo ảnh này cũng được ghi nhận ở đại tràng kế cận (*). (d) Hình ảnh MRI trên xung DWI mặt phẳng axial (b = 800 giây/mm2) cho thấy tín hiệu cao bên trong ổ áp xe (mũi tên) do nước bị hạn chế khuếch tán. (e) Bản đồ ADC tương ứng cho thấy sự khuếch tán của nước bị giảm biểu hiện dưới dạng tín hiệu thấp bên trong lõi áp xe (abscess core) (mũi tên).
Hình 5. “Dấu hiệu màu ngọc lam – Turquoise sign” và sự bắt thuốc phân thùy gan thoáng qua (transient segmental enhancement) trong áp xe gan. (a) MRI trên T2W mặt phẳng axial cho thấy ổ áp xe gan khu trú ở thùy gan trái (left hepatic lobe) với tín hiệu cao bên trong và nhiều dải vách ngăn phân nhánh (mũi tên) giống với khoáng chất màu ngọc lam (turquoise mineral). (b) MRI T1W xóa mỡ (FS) không tiêm thuốc tương phản mặt phẳng axial cho thấy tổn thương gan khu trú có tín hiệu thấp (mũi tên). (c) MRI T1W có tiêm thuốc tương phản ở thì động mạch mặt phẳng axial cho thấy tăng bắt thuốc xung quanh tổn thương (các đầu mũi tên) và tăng bắt thuốc của nhiều vách ngăn bên trong (mũi tên). (d) MRI T1W có tiêm thuốc tương phản ở thì muộn mặt phẳng axial cho thấy sự bắt thuốc kéo dài của các vách ngăn bên trong (mũi tên). Nuôi cấy thành phần trong ổ áp xe được chọc hút ra là K.pneumoniae.
Chẩn đoán phân biệt của áp xe gan sinh mủ và những cạm bẫy tiềm ẩn (Differential Diagnosis and Potential Pitfalls)
U gan (Hepatic Tumor)
Áp xe gan dạng đặc đang tổ chức hóa (A solid organizing hepatic abscess) có thể giống với u gan (liver tumor). Điều này được giải thích là do sự hấp thu mủ hoại tử (necrotic pus) dẫn đến sự co cụm vào trung tâm của thành còn lại có hai lớp. Tuy nhiên, áp xe vẫn tuân theo động học bắt thuốc tương phản (và cường độ tín hiệu trên hình ảnh MRI) của vỏ bao viêm (inflammatory capsule) với dấu hiệu bia bắn kép (Hình 6), bao gồm bắt thuốc tương phản diễn tiến ở lớp ngoài cùng của thành áp xe, một dấu hiệu gợi ý do viêm hơn là di căn (metastases) hoặc u gan ác tính nguyên phát như ung thư biểu mô đường mật (cholangiocarcinoma) hoặc ung thư biểu mô tế bào gan (hepatocellular carcinoma).
Hình 6. Áp xe gan dạng đặc đang tổ chức hóa ở bệnh nhân nam 69 tuổi bị sỏi ống mật chủ (choledocholithiasis) có biểu hiện sốt. (a) Hình ảnh CT có tiêm thuốc tương phản mặt phẳng axial thu được ở thì sớm (thì động mạch – arterial phase) cho thấy một nốt (nodule) có hình dạng “bia bắn – target”, với vùng bắt thuốc sớm ở trung tâm tương tự như nhu mô gan và có viền đậm độ thấp xung quanh (mũi tên). (b) Hình ảnh CT có tiêm thuốc tương phản ở thì muộn (delayed phase) mặt phẳng axial cho thấy bắt thuốc ở viền ngoại vi (đầu mũi tên) bao quanh vùng trung tâm đồng đậm độ. Ghi nhận không có thành phần dịch ở trung tâm do sự hấp thu mủ, làm cho áp xe có dạng đặc. Tổn thương này có thể khó phân biệt với ung thư biểu mô đường mật trong gan (intrahepatic cholangiocarcinoma).
Ung thư biểu mô đường mật trong gan hoặc di căn có thể biểu hiện với thành phân lớp (layered-wall), làm cho việc phân biệt với áp xe dạng đặc đang tổ chức hóa trở nên khó khăn. Tuy nhiên, ung thư biểu mô đường mật và di căn ung thư biểu mô tuyến thể xơ hóa (desmoplastic adenocarcinoma metastases) thường biểu hiện với bắt thuốc tăng dần vào trung tâm (central progressive enhancement) và thải thuốc ở vỏ bao (capsular washout) đồng thời, làm cho viền ngoại vi của chúng giảm đậm độ hoặc giảm tín hiệu so với lõi trung tâm ở thì tĩnh mạch cửa (portal phase) và thì muộn (equilibrium phase).
Vùng phân thùy gan tăng bắt thuốc và phù nề quanh tổn thương (perilesional edema) bao quanh ổ áp xe đang tổ chức hóa, hoặc các dấu hiệu kết hợp của ung thư biểu mô đường mật trong gan (ví dụ, co rút bao gan (capsular retraction), giãn đường mật ngược dòng đến u, hoặc teo thùy gan hoặc teo phân thùy gan) là các đặc điểm phụ trợ hữu ích có thể giúp phân biệt các tổn thương này. Trong một số trường hợp, có thể không thể phân biệt được và phải thực hiện chọc hút/sinh thiết.
Khối u bị hoại tử nhiều cũng có thể giống với áp xe gan. Tuy nhiên, kiểu bắt thuốc thành và cường độ tín hiệu trong khối u không cho thấy hình dạng “bia bắn” điển hình; mặt trong của thành cũng có thể có nhiều nốt hơn ở các khối u bị hoại tử (Hình 7). Hơn nữa, vùng phân thùy gan dạng hình chêm hoặc theo chu vi bắt thuốc sớm thoáng qua của tình trạng tăng bắt thuốc ở gan và/hoặc phù quanh tổn thương thường liên quan đến áp xe.
Hình 7. Khối u bị hoại tử (Necrotic tumor) giống với áp xe gan ở bệnh nhân nữ 38 tuổi nhập viện với đau hạ sườn phải và sốt nhẹ. Hình ảnh CT có tiêm thuốc tương phản tái tạo lại trên mặt phẳng coronal cho thấy một khối u giảm đậm độ với vách ngăn không đều bên trong ở thùy gan phải. Mặc dù có thể giống với áp xe, nhưng các đặc điểm của thành có các nốt bên trong và không có hình dạng bia bắn của áp xe nên tổn thương này gợi ý là một khối u dạng đặc bị hoại tử. Vôi hóa khu trú bên trong (mũi tên) cũng ủng hộ cho khối u hơn là áp xe gan. Phân tích bệnh học của mẫu mô cho thấy tổn thương là sarcoma phôi thai (embryonal sarcoma) biệt hóa kém bị hoại tử.
Tóm lại, mặc dù trong một số trường hợp, việc phân biệt áp xe với khối u gan hoại tử có thể rất khó khăn, nhưng các dấu hiệu hình ảnh quan trọng của áp xe là (a) hình dạng thành áp xe có nhiều lớp với bắt thuốc lớp trong cùng ở thì sớm và vẫn còn bắt thuốc ở thì muộn và lớp ngoài cùng bắt thuốc tăng dần ở thì muộn; và (b) các vùng phân thùy gan (areas of segmental) bắt thuốc thoáng qua. Hình ảnh trên xung DWI và bản đồ ADC cũng có thể giúp phân biệt. Áp xe thường cho thấy tín hiệu cao trên DWI với giá trị b cao và tín hiệu thấp tương ứng trên bản đồ ADC, trái ngược với phần u dạng nang hoặc hoại tử, nhưng có thể có sự chồng lấp nhau.
Nang nhỏ ở gan (Small Liver Cysts) hoặc Nang quanh đường mật (Peribiliary Cysts)
Các ổ áp xe nhỏ của đường mật (Cholangitic microabscesses) có thể giống với nang vì chúng có thể tăng tín hiệu rõ rệt trên hình ảnh T2W. Tuy nhiên, các ổ áp xe nhỏ thường cho thấy phù nề quanh tổn thương trên hình ảnh T2W và viền bắt thuốc mờ nhạt hoặc hạn chế khuếch tán trên DWI, các đặc điểm này không có ở các nang gan điển hình (typical liver cysts) (Hình 8).
Hơn nữa, nang quanh đường mật (peribiliary cysts) thường gặp ở những bệnh nhân bị xơ gan (cirrhosis) và đi theo các đường tĩnh mạch cửa trung tâm. Cần lưu ý rằng u mô thừa đường mật (biliary hamartomas) cũng có thể cho thấy viền mỏng bắt thuốc thấy rõ nhất trên hình ảnh MRI có tiêm gadolinium ở thì muộn. Tuy nhiên, trong trường hợp hamartoma đường mật sẽ không thấy phù nề quanh tổn thương hoặc hạn chế khuếch tán trên hình ảnh DWI. Về mặt lâm sàng, bệnh nhân bị áp xe nhỏ thường có các triệu chứng điển hình của viêm đường mật (cholangitis) gồm sốt, vàng da (jaundice) và đau hạ sườn phải, trong khi bệnh nhân bị hamartoma đường mật thì không có triệu chứng. Hạn chế khuếch tán trên DWI là đặc điểm hữu ích nhất để phân biệt tổn thương dạng nang có nhiễm trùng và không có nhiễm trùng.
Hình 8. Các ổ áp xe nhỏ ở đường mật giống với nang ở bệnh nhân nữ 68 tuổi bị tắc mật do ung thư biểu mô tụy (pancreatic adenocarcinoma) có biểu hiện vàng da và sốt. (a) MRI T2W mặt phẳng axial cho thấy phù nề quanh tổn thương (perilesional edema) có tín hiệu trung gian xung quanh tổn thương có tín hiệu cao (các mũi tên). (b) MRI T1W có tiêm thuốc tương phản mặt phẳng axial cho thấy viền bắt thuốc mờ nhạt (faint rim enhancement) của các tổn thương (các mũi tên), một dấu hiệu phù hợp với các ổ áp xe nhỏ ở đường mật. Bắt thuốc viền mờ nhạt cũng có thể thấy ở hamartoma đường mật dạng nang (cystic biliary hamartomas) nhưng chúng không có phù nề quanh tổn thương.
Vật liệu cầm máu tự tiêu (Absorbable Hemostatic Material)
Miếng gạc tự tiêu (Absorbable sponges) được đặt sau các can thiệp phẫu thuật như cắt gan (hepatic resections) hoặc ghép gan (liver transplant) để kiểm soát tình trạng chảy máu nhiều trong lúc phẫu thuật có thể giống với ổ áp xe, xuất hiện dưới dạng các túi khí khu trú (focal pockets of air) bên trong một ổ tụ dịch hỗn hợp (complex fluid collection). Cấu trúc này có thể thấy tại vị trí phẫu thuật tới 1 tháng sau phẫu thuật. Sự tương quan với dữ liệu lâm sàng và quy trình phẫu thuật phải đủ để tránh chẩn đoán sai. Tuy nhiên, khi không thể xác định sự tương quan với lâm sàng, việc phân biệt giữa hai tổn thương này có thể khó khăn. Các đặc điểm hình ảnh gợi ý là miếng gạc cầm máu tự tiêu hơn áp xe là tụ khí dạng đường thẳng (linear gas collections) và có tín hiệu thấp trên T2W.
Bệnh lao (Tuberculous)
Bệnh u hạt ở gan (Granulomatous Liver Disease)
Bệnh lao (Tuberculosis) tương ứng với tình trạng nhiễm trùng do Mycobacterium tuberculosis. Bất kể những tiến bộ trong việc phòng ngừa, chẩn đoán và điều trị, bệnh lao vẫn là một trong những bệnh truyền nhiễm nguy hiểm nhất thế giới. Bệnh lao ngoài phổi (Extrapulmonary tuberculosis) có liên quan đến gan thường thấy ở những bệnh nhân bị suy giảm miễn dịch có nhiễm trùng lan rộng. Mặc dù các rối loạn suy giảm miễn dịch khác nhau là yếu tố nguy cơ dẫn đến bệnh lao ngoài phổi, tỷ lệ mắc bệnh cao hơn ở những người bị nhiễm vi-rút gây suy giảm miễn dịch ở người (HIV) có số lượng tế bào CD4 < 200 tế bào/mL.
Lao ở gan có thể biểu hiện dưới dạng nốt nhỏ (micronodular) hoặc nốt lớn (macronodular). Tổn thương gan dạng nốt nhỏ, còn được gọi là lao kê (miliary tuberculosis), là dạng phổ biến nhất và là do sự lây lan theo đường máu của vi khuẩn M.tuberculosis từ phổi hoặc ngoài phổi. Dạng này thường liên quan đến tổn thương ở lách và lao kê ở phổi. Lao dạng nốt nhỏ (Micronodular tuberculosis) thường không được phát hiện trên hình ảnh và gan to (hepatomegaly) có thể là bất thường duy nhất. Khi phát hiện được các tổn thương gan khu trú, siêu âm có thể phát hiện các nốt rất nhỏ giảm âm, lan tỏa, không đặc hiệu. Tuy nhiên, vì các tổn thương thường quá nhỏ để có thể nhìn thấy, nên siêu âm có thể chỉ cho thấy gan tăng âm lan tỏa. Lao dạng nốt nhỏ có thể biểu hiện dưới dạng nhiều nốt rất nhỏ (0.5–2.0 mm) có đậm độ thấp mà không thấy rõ vòng tăng bắt thuốc trên CT (Hình 9). Khi khỏi bệnh, có thể xuất hiện các nốt vôi hóa nhỏ rải rác. Trên hình ảnh MRI, các tổn thương dạng nốt nhỏ có tín hiệu thấp trên T1W và tín hiệu cao trên T2W.
Chẩn đoán phân biệt của lao dạng nốt nhỏ bao gồm nhiễm nấm lan tỏa (disseminated fungal infections), Bệnh Bartonella (bartonellosis), bệnh sarcoidosis, lymphoma và di căn. Việc phân biệt các tổn thương này là khó khăn và đôi khi không thể thực hiện chỉ dựa trên các dấu hiệu hình ảnh. Tuy nhiên, vì lao ở gan thường được thấy trong nhiễm trùng lan rộng, nên tình trạng có tổn thương ở lách và hạch bạch huyết hoại tử ở bụng cùng xuất hiện sẽ làm tăng nghi ngờ về nhiễm trùng do vi khuẩn lao. Hơn nữa, khi có bệnh lý phổi kèm theo như thâm nhiễm hạt kê (miliary infiltrates) hoặc tổn thương phổi dạng hang, nên xem xét là bệnh lao.
Lao dạng nốt lớn ở gan thì hiếm gặp. Các nốt có thể đơn độc hoặc nhiều nốt nhưng số lượng ít hơn so với dạng nốt nhỏ. Thông thường, các nốt có hồi âm kém trên siêu âm và giảm đậm độ trên CT, và có thể thấy viền bắt thuốc ở ngoại vi sau khi tiêm thuốc tương phản. Trên hình ảnh MRI, các nốt có tín hiệu thấp trên T1W, nhưng trên T2W, chúng có thể cho thấy tín hiệu thay đổi (giảm hoặc tăng tín hiệu) tùy thuộc vào giai đoạn diễn tiến của bệnh. Vì các dấu hiệu hình ảnh không đặc hiệu, chẩn đoán thường đòi hỏi phải nuôi cấy hoặc phát hiện các u hạt bã đậu (caseating granulomas) của vi khuẩn lao trong các mẫu mô hoặc xác định bệnh lao bằng xét nghiệm phản ứng chuỗi polymerase (PCR – polymerase chain reaction) hoặc xét nghiệm trực khuẩn kháng axit (acid-fast bacillus testing).
Hình 9. Nhiễm lao lan tỏa (Disseminated tuberculosis infection) ở bệnh nhân nam 24 tuổi bị nhiễm HIV có biểu hiện với tình trạng đổ mồ hôi ban đêm và sốt. Hình ảnh CT có tiêm thuốc tương phản trên mặt phẳng axial cho thấy nhiều tổn thương rất nhỏ giảm đậm độ ở gan (mũi tên đen) và lách (đầu mũi tên), các dấu hiệu liên quan là hạch bệnh lý sau phúc mạc (các mũi tên trắng).
Bệnh Bartonella (bartonellosis)
Bệnh Bartonella (bệnh mèo cào – cat-scratch disease) là một bệnh nhiễm trùng do Bartonella henselae, một loại vi khuẩn gram âm xâm nhập vào vật chủ người thông qua vết cào hoặc vết cắn của mèo và thường ảnh hưởng nhất đến trẻ em và thanh thiếu niên. Các nốt sẩn nhỏ màu đỏ nâu có thể xuất hiện tại vị trí vết cào hoặc vết cắn. Các triệu chứng bắt đầu từ 1–3 tuần sau khi bị mèo cào hoặc cắn, với đau hạch bạch huyết nằm gần vị trí cào/cắn. Tổn thương các cơ quan nội tạng có thể xảy ra khi không có hạch bệnh lý (lymphadenopathy), biểu hiện là sốt không rõ nguyên nhân. Chẩn đoán bệnh bartonella được xác định bằng xét nghiệm huyết thanh học, xét nghiệm PCR hoặc sinh thiết.
Nhiễm trùng lan rộng được thấy ở 5%–10% các trường hợp. Bệnh bartonella ở gan (Hepatic bartonellosis) được đặc trưng bởi nhiều u hạt hoại tử (necrotizing granulomas) có kích thước từ 3 đến 30 mm, có hoặc không có gan to. Trên siêu âm, các tổn thương có thể khác nhau về hình dạng, nhưng phổ biến nhất là các nốt giảm âm không đặc hiệu.
Trên CT không tiêm thuốc tương phản, các tổn thương có đậm độ thấp so với nhu mô gan bình thường. Ba dạng khác nhau được mô tả trên CT có tiêm thuốc tương phản: (a) Giảm đậm độ kéo dài so với nhu mô gan (Hình 10), (b) đồng đậm độ so với các mô xung quanh và (c) viền bắt thuốc mờ nhạt. Trên hình ảnh MRI, các nốt Bartonella ở gan có tín hiệu thấp trên T1W và tín hiệu cao trên T2W với viền tăng bắt thuốc mờ nhạt và có thể có các nốt ở lách kèm theo. Các tổn thương này có các đặc điểm hình ảnh tương tự với các bệnh lý khác, như nhiễm nấm lan tỏa, lymphoma, bệnh sarcoidosis và di căn. Các bác sĩ chẩn đoán hình ảnh nên xem xét bệnh bartonella ở gan đối với trẻ em và thanh thiếu niên có hệ miễn dịch bình thường và không có bệnh ác tính đã biết trước, những bệnh nhân mà có nhiều tổn thương gan và đôi khi có các nốt ở lách kèm theo trên hình ảnh. Tuy nhiên, chẩn đoán xác định thường đòi hỏi phải phân tích huyết thanh học (serologic analysis) hoặc lấy mẫu mô (tissue sampling). Mặc dù bệnh có thể tự khỏi nhưng liệu pháp kháng sinh thường được áp dụng để tăng tốc độ phục hồi.
Hình 10. Bệnh bartonella ở gan ở một bé trai 6 tuổi bị sốt 3 tuần sau khi bị mèo cào. Hình ảnh CT có tiêm thuốc tương phản mặt phẳng axial cho thấy nhiều nốt giảm đậm độ ở gan (các mũi tên) và các hạch bạch huyết bệnh lý quanh tĩnh mạch cửa kèm theo (đầu mũi tên). Các tổn thương có thể không phân biệt được với di căn gan. Tuy nhiên, nhiều tổn thương ở gan được thấy ở bệnh nhân trẻ tuổi có hệ miễn dịch bình thường (immunocompetent) mà không có bệnh lý ác tính đã biết trước đó sẽ giúp gợi ý khả năng mắc bệnh bartonella ở gan.
Nhiễm trùng do Bartonella henselae ở bệnh nhân nhiễm HIV có thể gây ra bệnh u mạch dạng nang do trực khuẩn (bacillary peliosis) (từ tiếng Hy Lạp pelios có nghĩa là tím tái (dusky) hoặc tím (purple)). Bệnh u mạch dạng nang (Peliosis) là một bệnh lý mạch máu lành tính hiếm gặp có thể giống với u máu (hemangiomas) hoặc các khối u mạch máu khác. Trên siêu âm, có thể thấy nhiều tổn thương nhỏ, hình tròn, giảm âm ở gan và lách.
CT có thể cho thấy nhiều tổn thương đậm độ thấp hoặc đậm độ cao rải rác khắp nhu mô gan, và hình ảnh MRI trên T2W cho thấy các tổn thương khu trú có tín hiệu cao. Sự bắt thuốc tương phản có thể là dạng hình cầu (globular) đồng nhất, hướng tâm (centripetal) (từ ngoại vi vào trung tâm) hoặc ly tâm (centrifugal) (từ trung tâm ra ngoại vi), nhưng thường là liên tục, không có thải thuốc ở thì muộn do tích tụ thuốc tương phản trong các xoang gan giãn rộng. Do đó, các tổn thương vẫn hơi tăng đậm độ trên CT và hơi tăng tín hiệu trên MRI so với gan xung quanh ở thì tĩnh mạch cửa (Hình 11). Có ít hoặc không có hiệu ứng khối (mass effect) lên các mạch máu gan nằm kế cận. Chẩn đoán phân biệt gồm u máu (hemangiomas), di căn giàu mạch máu (hypervascular metastases) và sarcoma mạch máu nguyên phát biệt hóa tốt ở gan (well-differentiated primary hepatic angiosarcoma). U máu (Hemangiomas) cho thấy sự tăng bắt thuốc dạng hình cầu không liên tục, trái ngược với bệnh u mạch dạng nang (Peliosis) có bắt thuốc ở ngoại vi ban đầu thường liên tục.
Tuy nhiên, trong một số trường hợp, việc phân biệt có thể khó khăn chỉ dựa trên các dấu hiệu hình ảnh. Di căn giàu mạch máu và sarcoma mạch máu ở gan nguyên phát biệt hóa tốt thường giảm đậm độ hoặc đồng đậm độ với nhu mô gan trên hình ảnh ở thì tĩnh mạch cửa. Tiền sử lâm sàng cũng hữu ích giúp gợi ý chẩn đoán bệnh u mạch dạng nang do trực khuẩn (bacillary peliosis). Mặc dù bệnh u mạch dạng nang ở gan có thể thấy trong nhiều trường hợp khác nhau nhưng bệnh u mạch dạng nang (peliosis) ở gan thứ phát do nhiễm B.henselae thường được mô tả ở những bệnh nhân nhiễm HIV/AIDS.
Hình 11. Bệnh u mạch dạng nang do trực khuẩn (Bacillary peliosis) ở bệnh nhân nam 32 tuổi mắc HIV/AIDS có biểu hiện sốt. (a) Hình ảnh MRI T1W in-phase mặt phẳng axial cho thấy một nốt đồng tín hiệu đến tín hiệu thấp nhẹ có giới hạn không rõ ở phân thùy sau (posterior segment) của thùy gan phải (mũi tên). (b) Hình ảnh MRI T2W xóa mỡ (FS) mặt phẳng axial cho thấy cường độ tín hiệu từ trung bình đến cao của nốt (mũi tên). Các nốt dưới bao gan tương tự nhỏ hơn được thấy ở phía sau (các đầu mũi tên). (c) Hình ảnh MRI T1W xóa mỡ (FS) có tiêm thuốc tương phản mặt phẳng axial chụp ở thì sớm cho thấy nốt có tín hiệu thấp kèm bắt thuốc ở ngoại vi liên tục không đều ở gan phải (mũi tên). (d) Hình ảnh MRI T1W có tiêm thuốc tương phản mặt phẳng axial chụp ở thì muộn cho thấy có bắt thuốc muộn bên trong nốt (đầu mũi tên) có tín hiệu tương tự như tín hiệu của các cấu trúc tĩnh mạch gan xung quanh do thuốc tương phản bị giữ lại trong các xoang bị giãn ra của tổn thương.
Nhiễm trùng do vi-rút (Viral Infections)
Viêm gan cấp do virus thường do virus viêm gan A, B, C hoặc E gây ra. Các loại virus khác được biết là gây viêm gan bao gồm virus viêm gan D (phải nhiễm virus viêm gan B cùng lúc), HIV, coxsackievirus và virus herpes simplex. Mặc dù viêm gan herpes rất hiếm gặp, nhưng có thể gặp ở những bệnh nhân suy giảm miễn dịch và mang thai.
Biểu hiện lâm sàng khác nhau vì bệnh nhân có thể không có triệu chứng hoặc có thể sốt, khó chịu ở bụng và vàng da. Các biểu hiện ít gặp khác bao gồm suy gan cấp nặng (acute fulminant liver failure), nhiễm trùng không có triệu chứng dẫn đến xơ gan mạn tính và nhiễm trùng tiến triển nhanh dẫn đến xơ gan.
Chẩn đoán viêm gan do virus thường dựa trên biểu hiện lâm sàng, huyết thanh học, xét nghiệm PCR hoặc xét nghiệm hóa mô miễn dịch (Immunohistochemistry – IHC) khi phân tích mô bệnh học. Mặc dù các dấu hiệu hình ảnh ở bệnh nhân viêm gan virus là không đặc hiệu, nhưng hình ảnh đóng vai trò quan trọng để loại trừ các tình trạng bệnh lý khác có biểu hiện lâm sàng tương tự, như tắc nghẽn đường mật, bệnh lý di căn lan tỏa và xơ gan.
Các đặc điểm hình ảnh của viêm gan virus cấp tính trên siêu âm bao gồm gan to với nhu mô gan giảm âm, dẫn đến tăng tương đối độ hồi âm của bộ ba khoảng cửa (portal triads) và tạo ra hình ảnh “bầu trời đầy sao – starry sky”. Trên CT, phù quanh khoảng cửa, bắt thuốc không đồng nhất và các vùng đậm độ thấp có giới hạn rõ. Trên MRI, các vùng này có tín hiệu thấp trên T1W và tín hiệu cao trên T2W. Cần lưu ý rằng viêm gan virus cấp tính có thể biểu hiện với các dấu hiệu gan bình thường trên hình ảnh.
Các dấu hiệu ngoài gan ở những bệnh nhân bị viêm gan virus cấp tính bao gồm dày thành túi mật do phù nề (lên đến 70% bệnh nhân), có thể rất nổi bật và có thể giống với viêm túi mật cấp tính (acute cholecystitis). Tuy nhiên, ở những bệnh nhân bị viêm túi mật cấp tính, lòng túi mật giãn ra, trái ngược với những bệnh nhân bị viêm gan cấp tính có thể thấy tình trạng lòng túi mật xẹp (Hình 12).
Suy gan nhanh nặng (Fulminant hepatic failure) được định nghĩa là sự xuất hiện bệnh não gan (encephalopathy) trong vòng 8 tuần kể từ khi khởi phát triệu chứng ở bệnh nhân có gan khỏe mạnh trước đó, có thể dẫn đến xơ hóa hoặc tạo sẹo chỗ hợp lưu khi chụp CT và MRI theo dõi. Vôi hóa cũng có thể xuất hiện ở các vùng bị ảnh hưởng.
Mặc dù gan cũng có thể biểu hiện bình thường trong viêm gan virus mạn tính, nhưng có thể thấy cấu trúc nhu mô gan thô (coarsened hepatic echotexture) và nhu mô gan tăng âm trên siêu âm. Các đặc điểm trên CT và MRI có thể giống với các đặc điểm của xơ gan giai đoạn sớm.
Hình 12. Viêm gan virus cấp tính ở bệnh nhân nam 28 tuổi bị vàng da ứ mật (cholestatic jaundice). Hình ảnh MRI T2W mặt phẳng axial cho thấy thành túi mật dày lên đáng kể (mũi tên) do phù nề, với tình trạng xẹp lòng túi mật thứ phát. Cũng thấy phù quanh khoảng cửa lan rộng đến dây chằng liềm (mũi tên đầu).
Nhiễm ký sinh trùng (Parasitic Infections)
Áp xe gan do amip (Amebic Abscess)
Áp xe gan do amip là biến chứng ngoài đường ruột thường gặp nhất của nhiễm Entamoeba histolytica. Nhiễm trùng động vật nguyên sinh (protozoan infection) này là bệnh địa phương (endemic) ở Châu Phi, Đông Nam Á, Trung và Nam Mỹ.
Bệnh nhân bị áp xe gan do amip thường là người trưởng thành và nam giới (phổ biến gấp 10 lần ở nam so với nữ). Biểu hiện lâm sàng của nhiễm trùng gan là đau hạ sườn phải, sốt, ho và gan to. Chẩn đoán cần phải phát hiện kháng nguyên hoặc ADN đặc hiệu của E.histolytica trong các mẫu phân và kháng thể kháng amip trong huyết thanh.
Điều trị với metronidazole là phương pháp điều trị nội khoa chính và đủ để tiêu diệt hoàn toàn amip ở hầu hết bệnh nhân, thậm chí chỉ với một liều thuốc. Chọc hút (Aspiration) nhìn chung là không cần thiết ở những bệnh nhân bị áp xe gan do amip nhưng nên được xem xét ở những bệnh nhân có chẩn đoán không chắc chắn (trong đó áp xe sinh mủ (pyogenic abscess) hoặc áp xe gan do amip có bội nhiễm vi khuẩn là mối lo ngại). Ở những bệnh nhân thất bại với điều trị metronidazole (sốt kéo dài hoặc đau sau 4 ngày điều trị) và ở những bệnh nhân có ổ áp xe lớn có nguy cơ bị vỡ cao (đặc biệt là vỡ vào màng phổi hoặc màng ngoài tim).
Ổ áp xe biến mất trên hình ảnh có thể mất tới 2 năm sau khi bệnh nhân hết các biểu hiện lâm sàng; do đó, có bất thường hình ảnh tồn tại kéo dài thì không nên dẫn đến việc điều trị lại hoặc xét nghiệm thêm ở bệnh nhân có tình trạng lâm sàng cải thiện tốt.
Trên hình ảnh, áp xe gan do amip điển hình là một ổ đơn độc không có vách ngăn bên trong (unilocular), mặc dù có thể có vách ngăn (septa) trong 30% trường hợp. Khoảng 70%–80% các tổn thương là đơn độc và nằm ở thùy gan phải, thường nằm gần bao gan, và có thể khó phân biệt với áp xe gan sinh mủ có một ổ đơn độc không có vách ngăn bên trong (unilocular pyogenic abscess). Trên siêu âm, áp xe gan do amip biểu hiện dưới dạng một khối tròn hoặc bầu dục giảm âm và đồng nhất, với các thành phần có hồi âm kém bên trong (low-level internal echoes), thành không có hồi âm rõ rệt, và có tăng âm phía sau (distal through-transmission). Tổn thương gan khu trú kết hợp với sự gián đoạn cơ hoành gợi ý cao cho áp xe gan do amip.
Trên CT có tiêm thuốc tương phản, áp xe gan do amip là tổn thương có giới hạn rõ với các thành phần đậm độ dịch hỗn hợp bên trong và có viền bắt thuốc tương phản. Vỏ bao của ổ áp xe cũng có thể biểu hiện hình dạng “bia bắn – target” hoặc “viền đôi – double-rim” (Hình 13). Lan rộng ra ngoài gan là thường gặp. Các dấu hiệu hình ảnh trên MRI tương tự như áp xe sinh mủ khác, với tín hiệu thấp trên T1W và tín hiệu cao trên T2W, và thường kèm với phù nề quanh tổn thương.
Hình 13. Áp xe gan do amip ở bệnh nhân nữ 44 tuổi nhập viện với sốt và đau hạ sườn phải 3 tuần sau chuyến đi đến Trung Mỹ. Hình ảnh CT có tiêm thuốc tương phản mặt phẳng axial cho thấy một tổn thương giảm đậm độ có giới hạn rõ ở thùy gan phải, với hình dạng ‘bia bắn – target’ hoặc ‘viền đôi – double-rim’ của thành dày lên ở ngoại vi của ổ áp xe (mũi tên). Xét nghiệm huyết thanh dương tính với E. histolytica. Áp xe do amip có thể giống với áp xe sinh mủ có một ổ đơn độc và không có vách ngăn bên trong.
Bệnh sán dây Echinococcus (Echinococcus Infection)
Bệnh sán dây Echinococcus là bệnh lây truyền từ động vật sang người (zoonosis) trên toàn thế giới do ăn phải thức ăn hoặc nước bị nhiễm trứng của sán dây Echinococcus (Echinococcus tapeworm). Các dạng bệnh sán dây Echinococcus thường gặp nhất ở người là bệnh sán dây Echinococcus dạng nang (cystic) và dạng tổ ong (alveolar).
Bệnh sán dây Echinococcus dạng nang (Cystic echinococcosis) (bệnh nang sán hydatid – hydatid disease) là dạng phổ biến nhất và do Echinococcus granulosus gây ra, là một loại sán dây phân bố trên toàn thế giới. Gan là cơ quan thường bị ảnh hưởng nhiều nhất (70%–75%). Bệnh nhân có thể không có triệu chứng, đặc biệt là khi nang có kích thước nhỏ. Nang lớn hơn có thể gây đau bụng, có thể sờ thấy một cấu trúc dạng khối ở hạ sườn phải hoặc vàng da tắc mật. Phản ứng phản vệ (anaphylaxis) và lây lan sang các bộ phận khác của cơ thể có thể có khi nang vỡ. Nhiễm trùng bội nhiễm vi khuẩn (Bacterial superinfection) ở nang và tiến triển thành áp xe gan cũng đã được mô tả.
Nang sán hydatid trưởng thành (mature hydatid cyst) gồm 3 lớp: (a) lớp trong cùng (endocyst = inner layer – lớp mầm (germinal layer)), là mô sống bao quanh khoang trung tâm chứa đầy dịch nang sán hydatid; (b) lớp giữa (ectocyst = middle layer), là màng nhiều lớp không có tế bào do màng mầm tiết ra; và (c) lớp ngoài cùng (pericyst = outer layer), là một vỏ bao xơ dày tương ứng với phản ứng của nhu mô gan của vật chủ. Các nang con (Daughter cysts) có thể hiện diện trong nang sán mẹ và là kết quả của sự lõm vào trong của lớp trong cùng (endocyst invagination). Sự xuất hiện nang con là một dấu hiệu cho thấy nang sán còn sống (cyst viability). Nếu một nang con bị vỡ, các đầu sán non (scolices) sẽ đi vào dịch nang sán mẹ và tạo thành cặn lắng màu trắng (white sediment) được gọi là cát sán (hydatid sand).
Các đặc điểm hình ảnh của bệnh sán dây Echinococcosis có thể đủ để xác định chẩn đoán, đặc biệt là khi có hình ảnh các nang con (daughter cysts). Phát hiện kháng thể trong huyết thanh (serum antibodies) có thể hỗ trợ chẩn đoán, vì độ nhạy có thể lên tới 85%–98% đối với nang gan, nhưng độ đặc hiệu của tất cả các xét nghiệm bị hạn chế bởi phản ứng chéo (cross reactions).
Đặc điểm của bệnh nang sán hydatid trên siêu âm có thể từ nang đơn giản (purely cystic) đến tổn thương giả u dạng đặc (solid-appearing pseudotumors). Phân loại nang sán hydatid ở gan của Tổ chức Y tế Thế giới (WHO) theo dấu hiệu hình ảnh trên siêu âm rất hữu ích để đánh giá giai đoạn và hướng dẫn cách xử trí phù hợp. Sáu giai đoạn đã được mô tả:
+ Giai đoạn 1: Tổn thương dạng nang (Cystic lesion – CL): Nang đơn thùy hoạt động (active unilocular cyst) được thấy với thành phần bên trong nang có hồi âm trống đồng nhất và thành nang không thấy rõ.
+ Giai đoạn 2: Nang Echinococcus granulosus (CE) loại 1: Quan sát thấy một nang đơn giản đơn thùy hoạt động với thành phần bên trong nang có hồi âm trống đồng nhất và thấy rõ thành nang. Khi thay đổi tư thế bệnh nhân, có thể thấy các chấm nhỏ tăng âm do cát sán hydatid lắng đọng xuống (dấu hiệu bão tuyết – snowstorm sign).
+ Giai đoạn 3: Nang Echinococcus granulosus (CE) loại 2: Quan sát thấy một nang có nhiều vách ngăn tạo nhiều ngăn nhỏ bên trong với thành nang thấy rõ. Các nang con được phân cách bởi chất nền nang sán (hydatid matrix) có thể lấp đầy một phần hoặc toàn bộ nang mẹ đơn thùy theo kiểu hình ‘bánh xe nan hoa – spoke-wheel’.
+ Giai đoạn 4: Nang Echinococcus granulosus (CE) loại 3: Quan sát thấy một nang đơn thùy, hoạt động với màng trong cùng tách ra và nổi lơ lửng trong nang (dấu hiệu hoa súng – water lily sign). Dấu hiệu hoa súng được giải thích là do áp lực trong nang giảm do ký sinh trùng mất khả năng sống sót.
+ Giai đoạn 5: Nang Echinococcus granulosus (CE) loại 4: Quan sát thấy một nang chứa hỗn hợp các thành phần giảm âm và tăng âm (dạng giả khối u), không có các nang con bên trong. Nang này có thể biểu hiện dưới dạng ‘dấu hiệu cuộn len – ball of wool sign’, cho thấy các màng đang thoái hóa (Hình 14). Hầu hết các nang thuộc loại này là không hoạt động (không còn sống).
+ Giai đoạn 6: Nang Echinococcus granulosus (CE) loại 5: Các nang ở giai đoạn này được đặc trưng bởi thành nang bị vôi hóa một phần hoặc hoàn toàn. Vôi hóa một phần không phải lúc nào cũng cho thấy nang không còn sống (cyst death), nhưng vôi hóa hoàn toàn thành nang và các thành phần trung tâm thường cho thấy nang không còn sống.
Hình 14. Nang sán hydatid ở gan (Liver hydatid cyst) ở bệnh nhân nữ 31 tuổi có biểu hiện đau hạ sườn phải. Hình ảnh siêu âm mặt phẳng cắt ngang thùy gan phải cho thấy một khối tổn thương không đồng nhất (*) với thành phần hỗn hợp giảm âm và tăng âm (hình dạng “giả khối u – pseudotumor”) và màng thoái hóa (các mũi tên) nổi lơ lửng trong phần dịch của nang (dấu hiệu cuộn len – ball of wool sign).
Tương tự như các dấu hiệu trên siêu âm, các dấu hiệu trên CT tương ứng với giai đoạn phát triển của nang: đơn thùy (unilocular), có các nang con (daughter cysts), vôi hóa một phần (partially calcified) hoặc vôi hóa dày đặc (densely calcified). Thành nang có thể cho thấy tăng đậm độ trên hình ảnh không tiêm thuốc tương phản và các nang con cho thấy đậm độ thấp hơn nang mẹ (Hình 15). Các màng tách ra bên trong nang (dấu hiệu hoa súng – water lily sign) có thể cho thấy các vùng tăng đậm độ dạng đường. Nang vôi hóa dày đặc (densely calcified cyst) là dấu hiệu cho thấy nang không còn sống.
Hình 15. Nang sán hydatid ở gan ở bệnh nhân nam 42 tuổi đến từ Nam Mỹ, nhập viện với triệu chứng đau hạ sườn phải. Hình ảnh CT có tiêm thuốc tương phản mặt phẳng axial cho thấy các đặc điểm kinh điển của nang sán hydatid với nhiều nang con giảm đậm độ bên trong một nang lớn ở gan phải. Ghi nhận rằng các nang con (mũi tên) có đậm độ thấp hơn chất nền của nang mẹ (*).
Hình ảnh MRI thể hiện rõ nhất tổn thương quanh nang, chất nền hoặc cát sán hydatid (là mảnh vụn gồm các đầu sán non đã tách rời ra) và các nang con (Hình 16). Trên hình ảnh T1W và T2W, tổn thương quanh nang biểu hiện dưới dạng viền tín hiệu thấp (hypointense rim) do thành phần xơ và vôi hóa của nó. Chất nền của nang sán hydatid cho thấy tín hiệu trung gian đến tín hiệu thấp trên hình ảnh T1W và tín hiệu trung gian đến tín hiệu cao trên hình ảnh T2W.
Khi xuất hiện, các nang con (daughter cysts) cho thấy tín hiệu cao hơn trên hình ảnh T2W so với chất nền (matrix) với tín hiệu gần bằng dịch mật hoặc dịch não tủy (Hình 16). Sau khi tiêm thuốc tương phản, thành phần trong nang không bắt thuốc bao gồm cả vách ngăn. Tổn thương quanh nang xơ hóa có thể có bắt thuốc tương phản nhẹ ở thì muộn. Một số nang hydatid có thể có mức khí-dịch hoặc các giọt mỡ (Hình 17). Mỡ trong nang được cho là có nguồn gốc từ các thành phần lipid trong dịch mật, nghĩa là có sự vỡ thông thương nhau (communicating rupture). Phải cẩn thận để không nhầm lẫn đặc điểm này với các khối u tân sinh của gan chứa mỡ (fat-containing hepatic neoplasms) như u tuyến tế bào gan (hepatocellular adenoma) hoặc ung thư biểu mô tế bào gan (HCC) (cả hai đều là tổn thương dạng đặc và thường tăng sinh mạch máu).
Điều trị bệnh sán dây echinococcosis dạng nang bao gồm các thuốc chống ký sinh trùng như albendazole hoặc mebendazole, phẫu thuật (cắt bỏ quanh nang – pericystectomy), và/hoặc dẫn lưu qua da (percutaneous drainage) kèm tiêm thuốc diệt đầu sán (protoscolicidal substance) (tốt nhất là ethanol 95%).
Hình 16. Bệnh nang sán hydatid ở gan (Hepatic hydatid disease) ở bệnh nhân nam 37 tuổi đến từ Chile, nhập viện với triệu chứng đau hạ sườn phải.
(a) Hình ảnh MRI T2W mặt phẳng axial cho thấy tổn thương quanh nang (pericyst) với viền giảm tín hiệu rõ rệt (các mũi tên) do thành phần xơ hóa của tổn thương. Vôi hóa vỏ bao nang cũng có thể giải thích cho tín hiệu thấp quanh nang. Chất nền trong nang sán hydatid (*) cho thấy tín hiệu trung gian. Các nang con (đầu mũi tên) cho thấy nang còn sống và có tín hiệu cao trên T2W so với chất nền bên dưới.
(b) Hình ảnh MRI T1W in-phase mặt phẳng axial cho thấy tổn thương quanh nang xơ hóa với tín hiệu thấp (các mũi tên). Chất nền của nang sán hydatid (*) có tín hiệu trung gian. Các nang con (đầu mũi tên) thường có tín hiệu thấp hơn trên T1W so với chất nền nang sán.
(c, d) Hình ảnh MRI T1W có tiêm thuốc tương phản, xóa mỡ (FS), thì tĩnh mạch cửa (c) và thì muộn (d) mặt phẳng axial cho thấy không có sự bắt thuốc tương phản của các thành phần bên trong nang. Tổn thương quanh nang (đầu mũi tên) cho thấy sự bắt thuốc tương phản nhẹ.
Hình 17. Nang sán hydatid chứa mỡ ở bệnh nhân nữ 57 tuổi đến khám để đánh giá tổn thương gan.
(a) Hình ảnh CT không tiêm thuốc tương phản mặt phẳng axial cho thấy giọt mỡ đại thể (macroscopic fat globule) (mũi tên) bên trong tổn thương gan. Mỡ trong nang có thể có nguồn gốc từ các thành phần lipid trong dịch mật, nghĩa là có sự vỡ thông thương.
(b) Hình ảnh MRI T1W gradient-echo in-phase mặt phẳng axial cho thấy một nốt có tín hiệu cao (mũi tên) bên trong tổn thương.
(c) Hình ảnh MRI T1W gradient-echo opposed-phase mặt phẳng axial cho thấy là mỡ đại thể bên trong nang, một dấu hiệu được xác nhận bằng xảo ảnh dịch chuyển hóa học (chemical shift artifact) và xóa đi tín hiệu xung quanh thành phần lipid (mũi tên).
Chẩn đoán phân biệt của nang sán hydatid trong bệnh sán dây Echinococcus và những cạm bẫy tiềm ẩn
U tuyến dạng nang đường mật (Biliary Cystadenoma) hoặc Ung thư biểu mô tuyến dạng nang đường mật (Biliary Cystadenocarcinoma)
U tuyến nang đường mật (biliary cystadenoma) hoặc ung thư biểu mô tuyến nang đường mật (biliary cystadenocarcinoma) dạng nang có nhiều ngăn nhỏ bên trong (multiloculated) cho thấy có sự bắt thuốc tương phản của các vách ngăn (septa) và các nốt thành (wall nodules) bên trong, khác với đặc điểm vô mạch (avascular) (không bắt thuốc) của nang sán hydatid (Hình 18). Tuy nhiên, khi có vôi hóa của vách ngăn (septal calcifications) trong u tuyến nang đường mật (biliary cystadenoma) hoặc ung thư biểu mô tuyến nang đường mật (biliary cystadenocarcinoma), có thể không thấy được sự bắt thuốc rõ của vách ngăn bên trong.
Hình 18. Nang sán hydatid (Hydatid cyst) so với u gan dạng nang (cystic hepatic tumor).
(a, b) Nang sán hydatid ở bệnh nhân nữ 49 tuổi nhập viện với tổn thương dạng khối ở bụng.
(a) Hình ảnh MRI T1W gradient-echo in-phase trên mặt phẳng axial cho thấy tổn thương gan dạng nang có tín hiệu thấp kèm vách ngăn bên trong (đầu mũi tên).
(b) Hình ảnh MRI T1W có tiêm thuốc tương phản thì muộn trên mặt phẳng axial cho thấy không có bắt thuốc các thành phần bên trong nang và các vách ngăn có tín hiệu thấp (đầu mũi tên).
(c, d) U tuyến nang đường mật (Biliary cystadenoma) ở bệnh nhân nữ 57 tuổi đến khám để đánh giá tổn thương gan không xác định (indeterminate liver lesion).
(c) Hình ảnh MRI T1W gradient-echo in-phase trên mặt phẳng axial cho thấy tổn thương gan dạng nang đa thùy với các vách ngăn bên trong (mũi tên).
(d) Hình ảnh MRI T1W có tiêm thuốc tương phản kèm xóa mỡ trên mặt phẳng axial cho thấy các vách ngăn không đều bên trong có bắt thuốc tương phản mức độ vừa (mũi tên), đây là một đặc điểm hữu ích giúp phân biệt với nang sán hydatid
Nang gan xuất huyết (Hemorrhagic Liver Cyst) hoặc nang gan phức tạp (Complicated Liver Cyst) hoặc u mô thừa đường mật khổng lồ (Giant Bile Duct Hamartoma)
Cường độ tín hiệu cao trên xung T1W giúp phân biệt nang gan xuất huyết (Hemorrhagic Liver Cyst) hoặc nang gan phức tạp (Complicated Liver Cyst) hoặc u mô thừa đường mật khổng lồ (Giant Bile Duct Hamartoma) với nang sán hydatid (Hình 19). U mô thừa (hamartoma) đường mật khổng lồ có xu hướng xuất huyết (bleed), nhưng tình trạng xuất huyết trong nang sán hydatid là biến chứng cực kỳ hiếm gặp.
Hình 19. Nang gan xuất huyết (Hemorrhagic liver cyst) giống với nang sán hydatid ở bệnh nhân nữ 51 tuổi nhập viện vì đau thượng vị cấp.
(a) Hình ảnh MRI T2W trên mặt phẳng axial cho thấy một nang gan lớn có tín hiệu trung gian và các dải dạng cuộn sóng có tín hiệu thấp (mũi tên) có thể là các màng bị bong ra.
(b) Hình ảnh MRI T1W trên mặt phẳng axial cho thấy tín hiệu cao bên trong nang, một dấu hiệu phù hợp với thành phần xuất huyết. Xuất huyết trong nang hydatid là một biến chứng cực kỳ hiếm gặp và nên được coi là một chẩn đoán ít có khả năng xảy ra hơn.
Nang gan đơn giản (Simple Liver Cyst)
Nang sán hydatid đơn thùy (unilocular hydatid cyst) hiếm gặp nhưng có thể giống với nang gan (liver cyst). Các dấu hiệu hình ảnh sau đây có thể là manh mối duy nhất để chẩn đoán: cát sán trong nang hydatid, dày thành nang khu trú hoặc từng đoạn, nang sán echinococcal (nang hydatid) đồng thời có ở lách hoặc phổi, giãn đường mật quanh nang, teo thùy gan (lobar) hoặc phân thùy gan (segmental), nang vệ tinh (satellite cysts) và hình dạng nang thuôn dài. Tuy nhiên, việc phân biệt hai tổn thương này rất khó khăn và đôi khi không thể phân biệt được.
Bệnh sán lá gan lớn (Fascioliasis)
Bệnh sán lá lớn ở gan đường mật (Hepatobiliary fascioliasis) là do sán lá Fasciola hepatica gây ra. Nguồn lây nhiễm chính là do ăn rau cải xoong (watercress) hoặc các loại rau xanh tương tự có chứa ấu trùng dạng nang (metacercaria) có khả năng lây nhiễm của ký sinh trùng (parasite). Bệnh sán lá gan lớn là bệnh địa phương (endemic) ở một số khu vực Nam Mỹ, Cuba, Ai Cập, Iran, Thổ Nhĩ Kỳ và một phần Tây Âu.
Nhiễm trùng ở vật chủ cuối cùng được chia thành 2 giai đoạn: giai đoạn nhu mô (parenchymal)/gan (hepatic) (di chuyển – migratory) và giai đoạn đường mật (biliary phase). Trong giai đoạn nhu mô, sán non mới nở (hatched juvenile flukes) xuyên qua thành ruột, sau đó di chuyển vào khoang phúc mạc và xuyên qua bao gan.
Trong quá trình di chuyển của sán lá gan (liver fluke), nhu mô gan bị phá hủy về mặt cơ học và xuất hiện phản ứng viêm quanh các đường đi của sán. Giai đoạn đường mật bắt đầu khi ký sinh trùng xâm nhập vào đường mật của gan. Tại cây đường mật, sán lá trưởng thành và đẻ trứng.
Về mặt lâm sàng, bệnh nhân bị bệnh sán lá gan lớn (fascioliasis) có biểu hiện đau hạ sườn phải do kích thích bao gan và các ổ áp xe dưới bao gan do ký sinh trùng tạo ra. Sốt, sụt cân, ngứa và phát ban ở da cũng có thể xuất hiện. Tăng bạch cầu ái toan trong máu xảy ra ở giai đoạn gan (hepatic phase). Chẩn đoán xác định được thực hiện dựa trên các xét nghiệm huyết thanh học (serologic tests) hoặc tìm trứng sán trong dịch mật, nhu mô gan được chọc hút qua nội soi hoặc chọc hút qua da, hoặc trong phân.
Triclabendazole là loại thuốc được Tổ chức Y tế Thế giới khuyến cáo lựa chọn để điều trị bệnh sán lá gan lớn. Tuy nhiên, loại thuốc này chưa được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chấp thuận. Nitazoxanide có thể là một lựa chọn thay thế cho triclabendazole, nhưng cần nhiều nghiên cứu hơn về hiệu quả và khả năng dung nạp của thuốc.
Trên siêu âm, bệnh nhân bị bệnh sán lá gan lớn (fascioliasis) có các nốt giảm âm, có tính hợp lưu, giới hạn không rõ, nằm dưới bao gan trong giai đoạn nhu mô (Hình 20). Trong giai đoạn đường mật, thường có dày thành túi mật (gallbladder) hoặc ống mật chủ (common bile duct) và giãn nhẹ đường mật trong gan do viêm đường mật (cholangitis). Ký sinh trùng (parasite) có thể được thấy trong ống mật chủ hoặc túi mật dưới dạng cấu trúc tăng âm có hình chiếc lá (leaflike) hoặc hình cong giống ốc sên (snail-like), kích thước 5–25 mm, có thể di chuyển trong quá trình siêu âm nếu nó còn sống.
Hình 20. Bệnh sán lá gan lớn (Hepatic fascioliasis) ở bệnh nhân nam 60 tuổi, nhập viện với triệu chứng sốt, đổ mồ hôi ban đêm, và tiền sử ăn rau cải xoong 3 tháng trước khi nhập viện. Hình ảnh siêu âm (US) mặt cắt dọc (sagittal) thùy gan trái cho thấy các nốt giảm âm có tính hợp lưu, giới hạn không rõ (nằm giữa các thước đo; mũi tên) được bao quanh bởi nhu mô gan bị viêm tăng âm nhẹ. Các xét nghiệm cận lâm sàng xác nhận tăng bạch cầu ái toan (eosinophilia) 60%, kháng thể globulin miễn dịch G (immunoglobulin G antibodies) dương tính với Fasciola, và có trứng Fasciola trong phân của bệnh nhân.
Trên hình CT, có thể thấy nhiều nốt nhỏ (đường kính lên đến 2–3 cm), có tính hợp lưu, nằm dưới bao gan với giới hạn không rõ (Hình 21). Những nốt này có xu hướng hội tụ về rốn gan theo bộ ba cửa trung tâm (central portal triads). Các dải giảm đậm độ do viêm đi thành một đường và được thấy rõ nhất ngay bên dưới bao gan. Có thể thấy các hạch bạch huyết phản ứng (Reactive lymph nodes) và dịch quanh gan (perihepatic fluid). Tụ máu dưới bao gan là một biến chứng hiếm gặp nhưng có thể gây tử vong.
Hình 21. Bệnh sán lá gan lớn ở bệnh nhân nữ 59 tuổi, nhập viện với triệu chứng đau hạ sườn phải. Hình ảnh chụp cắt lớp vi tính (CT) có tiêm thuốc tương phản trên mặt phẳng axial cho thấy một vùng viêm lớn ở phân thùy trước của gan phải, với nhiều ổ áp xe nhỏ (microabscesses) vệ tinh xung quanh (các đầu mũi tên) đi theo đường đi của các tĩnh mạch.
Trên hình ảnh MRI, 5 kiểu hình ảnh bệnh sán lá gan lớn đã được mô tả: (a) viêm quanh gan (perihepatitis) hoặc viêm bao gan (capsular inflammation); (b) các dải dạng đường dưới bao gan-quanh tĩnh mạch cửa có giới hạn không rõ (Hình 22); (c) các vùng viêm gan theo phân thùy gan với dạng bản đồ (geographic borders); (d) ổ áp xe có bắt thuốc viền; và (e) xơ hóa khu trú sau viêm. Các dải tổn thương, vùng viêm nhu mô gan và các ổ áp xe được đặc trưng bởi tín hiệu thấp trên xung T1W và tín hiệu cao trên xung T2W, và có thể cho thấy có hạn chế khuếch tán trên xung DWI (Hình 22d).
Xơ hóa ở giai đoạn muộn (Late fibrosis) cho thấy tín hiệu thấp trên xung T1W và T2W. Chụp cộng hưởng từ đường mật (MR cholangiography) có thể cho thấy ký sinh trùng đường mật bên trong đoạn xa của ống mật chủ hoặc túi mật dưới dạng hình khuyết lấp đầy (filling defects) có tín hiệu thấp, hình thuôn dài, giới hạn không rõ (Hình 22e).
Hình 22. Bệnh sán lá gan lớn ở bệnh nhân nam 60 tuổi, nhập viện với triệu chứng sốt, đổ mồ hôi ban đêm, và tiền sử ăn rau cải xoong 3 tháng trước khi nhập viện (cùng bệnh nhân như trong Hình 20).
(a) Hình ảnh MRI T1W gradient-echo in-phase trên mặt phẳng axial cho thấy các dải dạng đường có tín hiệu thấp, giới hạn không rõ ở các vùng dưới bao gan tại phân thùy bên của gan trái và phân thùy sau của gan phải (các mũi tên).
(b) Hình ảnh MRI T1W có tiêm thuốc tương phản kèm xóa mỡ (FS) chụp ở thì động mạch trên mặt phẳng axial cho thấy sự bắt thuốc sớm của các dải viêm dạng đường (các mũi tên) và nhu mô gan xung quanh.
(c) Hình ảnh MRI T1W có tiêm thuốc tương phản kèm xóa mỡ (FS) chụp ở thì muộn trên mặt phẳng axial cho thấy các dải dạng đường trong nhu mô gan do ký sinh trùng vẫn còn bắt thuốc tương phản (các mũi tên).
(d) Hình ảnh MRI xung DWI (với b = 800 giây/mm2) mô tả sự hạn chế khuếch tán của nước (restricted water diffusion) trong các dải dạng đường có giới hạn không rõ, không đều ở dưới bao gan của thùy gan trái, chạy hướng về trung tâm rốn gan (các mũi tên). Ổ viêm thứ hai dưới bao gan ở phân thùy sau (đầu mũi tên) cũng cho thấy sự hạn chế khuếch tán nước.
Hình 22e. Hình ảnh MRI T2W trên mặt phẳng coronal cho thấy hình khuyết lấp đầy (filling defects) dạng đường không đều có tín hiệu thấp trong ống mật chủ đoạn xa (đầu mũi tên), các dấu hiệu này được xác nhận qua nội soi là ký sinh trùng còn sống.
Chẩn đoán phân biệt của bệnh sán lá gan lớn và những cạm bẫy tiềm ẩn
Bệnh Caroli (Caroli Disease) và Viêm xơ hóa đường mật (Sclerosing Cholangitis)
Bệnh sán lá lớn ở gan và đường mật (Hepatobiliary fascioliasis) có thể giống với bệnh Caroli và viêm xơ hóa đường mật. Các chấm bắt thuốc tương phản bên trong các nốt đậm độ thấp không bắt thuốc nằm quanh các tĩnh mạch cửa (periportal) có thể giống với “dấu hiệu chấm trung tâm” (central dot sign) được thấy trong bệnh Caroli (Hình 23). Các dải dạng đường quanh tĩnh mạch cửa của sán lá gan có thể giống với các dấu hiệu của viêm xơ hóa đường mật.
Hình 23. Bệnh sán lá lớn ở gan và đường mật giống với bệnh Caroli ở bệnh nhân nữ 62 tuổi. Hình ảnh CT có tiêm thuốc tương phản trên mặt phẳng axial cho thấy các chấm bắt thuốc tương phản (các đầu mũi tên) nằm bên trong các nốt đậm độ thấp không bắt thuốc nằm quanh tĩnh mạch cửa (periportal), những dấu hiệu này tương ứng với các ổ áp xe quanh mạch máu và tạo ra hình ảnh tương tự như “dấu hiệu chấm trung tâm – central dot sign” được mô tả trong bệnh Caroli. Các dải tổn thương dạng đường phân bố hướng vào trung tâm (centripetal distribution), và tăng bạch cầu ái toan trong máu nên gợi ý đến khả năng nhiễm sán lá gan lớn. Chẩn đoán sán lá gan lớn đã được xác định sau khi tìm thấy trứng ký sinh trùng trong phân của bệnh nhân.
Khối u (Neoplasms)
Ung thư biểu mô đường mật trong gan (Intrahepatic cholangiocarcinoma), bệnh lý di căn (metastatic disease), và ung thư biểu mô túi mật giai đoạn tiến triển tại chỗ (locally advanced gallbladder carcinoma) có thể có hình ảnh tương tự như bệnh sán lá gan lớn đường mật. Tuy nhiên, các dải tổn thương dạng đường và quan trọng hơn là tăng bạch cầu ái toan trong máu nên gợi ý đến khả năng nhiễm sán lá gan lớn (fascioliasis).
Bệnh sán máng (Schistosomiasis)
Sán lá máu Trematode (Trematode blood flukes) thuộc giống Schistosoma gây ra bệnh sán máng (schistosomiasis). Có 5 loài sán gây nhiễm trùng ở người; trong đó, Schistosoma mansoni và Schistosoma japonicum là những loài phổ biến nhất ảnh hưởng đến gan. Bệnh sán máng là bệnh địa phương (endemic) ở các khu vực nhiệt đới và cận nhiệt đới thuộc Châu Phi, Châu Á, Nam Mỹ và Caribe. Khách du lịch đến các vùng có bệnh lưu hành có nguy cơ mắc bệnh sán máng cấp tính, được gọi là bệnh Katayama (Katayama disease), cũng như bệnh mạn tính.
Sán máng (Schistosomes) xâm nhập qua da người và di chuyển đến vị trí cư trú của chúng trong các tĩnh mạch mạc treo (mesenteric veins). Trứng sán có thể được vận chuyển qua tĩnh mạch cửa (portal vein) đến gan, và gan là nơi mà trứng sán trú ngụ trong các tiểu tĩnh mạch (venules) gây ra sự hình thành u hạt (granuloma formation), tăng áp lực tiền xoang gan (presinusoidal hypertension), và đặc biệt với nhiễm S. japonicum, cuối cùng sẽ gây vôi hóa (calcifications).
Chẩn đoán bệnh sán máng được thực hiện dựa trên dữ liệu dịch tễ học, tăng bạch cầu ái toan (eosinophilia), sự hiện diện của trứng sán còn sống trong mẫu phân, hoặc kết quả xét nghiệm huyết thanh dương tính với sán máng (Schistosoma). Điều trị đầu tay (first-line) cho bệnh sán máng là các thuốc diệt giun sán (anthelminthic drugs) như praziquantel.
Các đặc điểm hình ảnh của bệnh sán máng (schistosomiasis) thường không được phát hiện cho đến nhiều năm sau khi nhiễm trùng ban đầu, mặc dù gan lách to (hepatosplenomegaly) và nhiều tổn thương dạng nốt nhỏ khu trú ở gan đã được mô tả trong một số trường hợp cấp tính. Các thay đổi của xơ hóa quanh tĩnh mạch cửa (periportal fibrosis) có thể được thấy trên siêu âm. Trứng của loài S.mansoni tương đối lớn hơn, có xu hướng trú ngụ trong các tĩnh mạch cửa lớn hơn ở vùng rốn gan; trên siêu âm sẽ thấy các dải dày tăng âm, có tính chất xơ hóa nằm dọc theo tĩnh mạch cửa và các nhánh của nó.
Hình ảnh mắt bò “bull’s-eye” đã được báo cáo trong trường hợp nhiễm S.mansoni và là hình ảnh được tạo ra bởi tĩnh mạch cửa có hồi âm trống được bao quanh bởi một lớp mô xơ có hồi âm dày. Trứng của S.japonicum tương đối nhỏ hơn, lắng đọng dọc theo các tĩnh mạch cửa nhỏ hơn ở ngoại vi của gan; siêu âm cho thấy các vách ngăn tăng âm có hình đa giác giống với hình dạng “vảy cá – fish scale” (kiểu hình dạng khảm – mosaic pattern).
Trên hình ảnh CT, hình ảnh kinh điển trong nhiễm S.japonicum là sự hiện diện của các vách bị vôi hóa (calcified septa), thường hướng vuông góc với bao gan, làm gan có hình dạng “mai rùa – tortoise shell” hoặc “lưng rùa – turtle back”. Các dấu hiệu khác bao gồm các dải đậm độ thấp quanh tĩnh mạch cửa có bản chất là các vách xơ hóa, lan tỏa đều khắp gan. Trên hình ảnh MRI, các vách này có tín hiệu thấp đến đồng tín hiệu trên xung T1W và tín hiệu cao trên xung T2W. Các dải xơ hóa quanh tĩnh mạch cửa cho thấy sự bắt thuốc tương phản muộn rõ rệt sau khi tiêm thuốc (Hình 24b). Các dấu hiệu liên quan có thể bao gồm xơ gan (liver cirrhosis) và các dấu hiệu của tăng áp tĩnh mạch cửa (portal hypertension).
Chẩn đoán phân biệt của bệnh sán máng và những cạm bẫy tiềm ẩn
Viêm gan tự miễn (autoimmune hepatitis)
Việc phân biệt viêm gan tự miễn với bệnh sán máng có thể khó khăn nếu chỉ dựa vào các dấu hiệu hình ảnh đơn thuần. Các vách xơ hóa (fibrous septa) tương tự trong nhu mô gan có thể được thấy ở cả hai bệnh (Hình 24). Các yếu tố dịch tễ học, lâm sàng và kết quả xét nghiệm (kháng thể tự miễn trong huyết thanh – serum autoantibodies) là chìa khóa để đưa ra chẩn đoán chính xác.
Hình 24. Bệnh sán máng (Schistosomiasis) so với viêm gan tự miễn (autoimmune hepatitis).
(a, b) Bệnh sán máng ở bệnh nhân nam 42 tuổi. (a) Hình ảnh MRI T1W xóa mỡ (FS) trên mặt phẳng axial cho thấy các vách xơ dày có tín hiệu thấp (các mũi tên). (b) Hình ảnh MRI T1W xóa mỡ (FS) có tiêm thuốc tương phản trên mặt phẳng axial cho thấy sự bắt thuốc của các dải xơ dưới bao gan (các mũi tên).
(c, d) Viêm gan tự miễn (Autoimmune hepatitis) ở bệnh nhân nữ 51 tuổi. (c) Hình ảnh MRI T1W gradient-echo in-phase trên mặt phẳng axial cho thấy xơ hóa dưới bao gan (subcapsular fibrosis) với các dải dày và các vùng hợp lưu có tín hiệu thấp (các mũi tên).
(d) Hình ảnh MRI T1W xóa mỡ (FS) có tiêm thuốc tương phản trên mặt phẳng axial cho thấy sự bắt thuốc muộn của các dải dày và các vùng xơ hóa hợp lưu (các mũi tên) với các đặc điểm hình ảnh tương tự như ở bệnh nhân bị sán máng (schistosomiasis) trong hình a và b.
Bệnh sán lá gan nhỏ (Clonorchiasis) (Viêm đường mật sinh mủ tái phát – Recurrent Pyogenic Cholangitis)
Bệnh sán lá gan nhỏ (Clonorchiasis) được gây ra do sán lá gan Clonorchis sinensis và là bệnh địa phương (endemic) ở miền đông nước Nga và Mãn Châu (Manchuria), Hàn Quốc (South Korea), Trung Quốc đại lục, Đài Loan, và miền bắc Việt Nam. Con người bị nhiễm bệnh do ăn phải ấu trùng nang (metacercariae) có trong cá nước ngọt còn sống. Ấu trùng nang đi lên đường mật để cư trú trong đường mật trong gan có kích thước trung bình và nhỏ, tại đây ấu trùng nang có thể làm tắc đường mật (biliary obstruction), viêm đường mật sinh mủ tái phát, hẹp đường mật (biliary strictures), và ung thư biểu mô đường mật (cholangiocarcinoma). Các tế bào tiết chất nhầy do ký sinh trùng gây ra sẽ tạo ra dịch mật có hàm lượng chất nhầy cao, khi kết hợp với sán lá trưởng thành và trứng sẽ trở thành búi (nidus) cho tình trạng bội nhiễm vi khuẩn và hình thành sỏi trong gan.
Trên siêu âm, bệnh sán lá gan nhỏ (clonorchiasis) có thể biểu hiện dưới dạng giãn nhẹ đến vừa lan tỏa đường mật nhỏ trong gan và sỏi (stones) hoặc bùn (sludge) trong lòng đường mật, với tình trạng không giãn hoặc giãn rất nhẹ (minimal) ở các đường mật lớn hơn và không có tổn thương gây tắc nghẽn. Đôi khi, sán lá gan (flukes) hoặc tập hợp trứng sán được biểu hiện dưới dạng các ổ (foci) tăng âm không có bóng lưng hoặc đúc khuôn (casts) bên trong đường mật. Các dấu hiệu trên CT và MRI mô tả tương tự các dấu hiệu trên siêu âm, cụ thể là giãn nhẹ đến vừa đường mật ngoại vi trong gan mà không có tổn thương khu trú gây tắc nghẽn.
Sỏi trong gan (Intrahepatic stones) cũng có thể được thấy (Hình 25). Sự bắt thuốc tương phản quanh đường mật có thể được phát hiện nếu xuất hiện tình trạng xơ hóa. Chẩn đoán phân biệt bao gồm sỏi trong gan không do ký sinh trùng (nonparasitic hepatolithiasis) và viêm xơ hóa đường mật (sclerosing cholangitis). Viêm xơ hóa đường mật khác với bệnh sán lá gan nhỏ ở chỗ viêm xơ hóa đường mật gây dày thành đường mật nhiều hơn và giãn đường mật không liên tục (chỗ giãn chỗ không giãn).
Thuốc diệt giun sán praziquantel là phương pháp điều trị được lựa chọn. Ở những bệnh nhân bị viêm đường mật sinh mủ tái phát, có thể cần dùng kháng sinh và nội soi hoặc phẫu thuật để lấy sỏi.
Hình 25. Bệnh sán lá gan nhỏ (Clonorchiasis) và viêm đường mật sinh mủ tái phát (recurrent pyogenic cholangitis) ở bệnh nhân nữ 54 tuổi có biểu hiện sốt và vàng da (jaundice). Hình ảnh CT có tiêm thuốc tương phản mặt phẳng axial cho thấy giãn đường mật trong gan mức độ trung bình mà không có tổn thương khu trú gây tắc nghẽn. Ghi nhận sỏi và bùn trong gan tăng đậm độ (các mũi tên).
Nhiễm nấm (Fungal Infections)
Nhiễm nấm xâm lấn (Invasive fungal infection) là một biến chứng của tình trạng giảm bạch cầu đa nhân trung tính kéo dài (prolonged neutropenia) ở bệnh nhân bị bệnh lý huyết học ác tính (hematologic malignancies), ở người nhận ghép tế bào gốc tạo máu (hematopoietic stem cell transplant recipients) hoặc người nhận ghép tạng đặc (solid-organ transplant recipients), và ở các bệnh nhân khác bị suy giảm miễn dịch (immunosuppressed). Mặc dù các loài Candida, Aspergillus và Cryptococcus neoformans chiếm 80% tổng số các trường hợp nhiễm nấm, nhưng phổ các mầm bệnh nấm cơ hội (opportunistic fungal pathogens) tiềm ẩn cũng bao gồm histoplasmosis, mucormycosis, và các tác nhân gây bệnh mới xuất hiện như nấm men (yeasts) bao gồm Trichosporon và Blastoschizomyces, và nấm sợi trong suốt (hyaline hyphomycetes) như Fusarium.
Việc nhận biết sớm nhiễm nấm ở gan là rất quan trọng để bắt đầu điều trị và tránh các biến chứng gây tử vong ở những bệnh nhân bị suy giảm miễn dịch này. Tuy nhiên, hình ảnh không thể được sử dụng để xác định tác nhân gây bệnh đặc hiệu vì nhiều loại bệnh nấm có chung các đặc điểm tương tự trên siêu âm, CT và MRI.
Nhiễm nấm Candida (Candidiasis)
Nhiễm nấm Candida ở gan (Hepatic candidiasis) ngày càng được công nhận là một biểu hiện của nhiễm nấm Candida lan tỏa (disseminated candidiasis) ở các bệnh nhân bị suy giảm miễn dịch; chẩn đoán hình ảnh đóng vai trò quan trọng trong việc phát hiện bệnh kịp thời. Loại nấm phổ biến nhất gây nhiễm trùng ở gan và lách là các loài Candida. Bệnh nhân thường biểu hiện với sốt không đáp ứng với kháng sinh thông thường. Tuy nhiên, cấy máu (Blood cultures) chỉ dương tính trong 50% các trường hợp.
Do đó, việc xác định chẩn đoán thường đòi hỏi các xét nghiệm bổ sung, như xét nghiệm phát hiện beta-D-glucan (một thành phần của thành tế bào của các loài Candida và các loại nấm khác), xét nghiệm PCR, hoặc lấy mẫu mô. Vì tỷ lệ tử vong (mortality rate) ở bệnh nhân nhiễm nấm Candida xâm lấn là 30% mặc dù đã điều trị thuốc kháng nấm (antifungal therapy) nên việc nghi ngờ và phát hiện sớm là điều rất cần thiết.
Các đặc điểm trên siêu âm của nhiễm nấm Candida ở gan và lách đã được tóm tắt thành 4 dạng:
(a) Dạng ‘bánh xe trong bánh xe’ (wheel-within-wheel pattern), bao gồm một ổ (nidus) giảm âm biểu hiện cho các mảnh vụn (debris) của mô nấm hoại tử, một vòng tăng âm trong cùng bao gồm các tế bào viêm, và một vòng giảm âm ở ngoại vi biểu hiện cho tình trạng xơ hóa.
(b) Dạng ‘mắt bò’ (bull’s-eye appearance), tương tự như dạng bánh xe trong bánh xe nhưng không có ổ (nidus) giảm âm và chỉ bao gồm tổn thương viêm tăng âm ở trong cùng và vòng xơ hóa giảm âm ngoài cùng (Hình 26)
(c) Dạng nốt giảm âm (hypoechoic nodule), là dạng thường gặp nhất nhưng ít đặc hiệu nhất, và là kết quả của tình trạng xơ hóa của vùng đã từng bị viêm trước đó;
(d) Dạng ổ (focus) tăng âm của sẹo hoặc vôi hóa với bóng lưng phía sau (posterior acoustic shadowing) thay đổi. Dạng cuối cùng này xuất hiện ở các giai đoạn muộn hơn của nhiễm trùng và thường cho thấy sự thoái triển sớm (early resolution).
Hình 26. Nhiễm nấm Candida tại gan (Hepatic candidiasis) ở bệnh nhân nam 63 tuổi bị bệnh bạch cầu cấp dòng tủy (acute myelogenous leukemia) có biểu hiện sốt. Hình ảnh siêu âm Doppler màu thu được trong quá trình sinh thiết gan bằng kim (liver needle biopsy) cho thấy một tổn thương giảm âm có giới hạn rõ (hypoechoic well-defined lesion) với một nốt tăng âm ở trung tâm (mũi tên) và dạng ‘mắt bò – bull’s-eye’. Các kết quả nuôi cấy sau đó cho thấy sự phát triển của Candida albicans.
Hình ảnh CT thường cho thấy các tổn thương nhỏ giảm đậm độ ở gan và lách (Hình 27). Đôi khi, các chấm rất nhỏ (tiny foci) tăng đậm độ được thấy ở trung tâm của các nốt viêm, có thể biểu hiện cho sợi nấm giả (pseudohyphae), điều này giúp phân biệt các tổn thương này với nang gan lành tính (benign liver cysts). Ở những bệnh nhân nghi ngờ nhiễm nấm gan, CT thì động mạch cho thấy nhiều tổn thương ở gan hơn so với CT được chụp ở các thì khác, và cho thấy nhiều tổn thương hơn với kiểu bắt thuốc của nhiễm trùng. Khoảng 1/3 tổn thương có thể tăng đậm độ mà không có vùng giảm đậm độ ở trung tâm trên thì động mạch. Bắt thuốc viền (Rim enhancement) cũng có thể được thấy.
Hình 27. Nhiễm nấm Candida lan tỏa (Disseminated candidiasis) ở bệnh nhân bị giảm bạch cầu đa nhân trung tính (neutropenia) và bệnh bạch cầu cấp dòng tủy (acute myeloid leukemia). Hình ảnh CT có tiêm thuốc tương phản trên mặt phẳng axial cho thấy nhiều ổ áp xe nhỏ giảm đậm độ ở gan. Các chấm rất nhỏ (Tiny foci) tăng đậm độ (các đầu mũi tên) được thấy trong một số ổ áp xe, có thể đại diện cho sợi nấm giả (pseudohyphae), đây là một dấu hiệu giúp phân biệt các tổn thương này với nang gan lành tính (benign liver cysts). Ghi nhận tổn thương ở lách (mũi tên).
Hình ảnh MRI có vẻ vượt trội hơn so với CT và siêu âm trong việc phát hiện các ổ nhiễm nấm (fungal foci). Ở những bệnh nhân bị sốt dai dẳng hoặc không đáp ứng với thuốc kháng sinh kháng khuẩn, hình ảnh MRI cho thấy độ nhạy 100% và độ đặc hiệu 96% trong chẩn đoán nhiễm nấm gan – lách (Hình 28). Các tổn thương biểu hiện giảm tín hiệu rất nhẹ (minimally hypointense) trên xung T1W và tăng tín hiệu rõ rệt (markedly hyperintense) trên xung T2W. Tùy thuộc vào mức độ hồi phục tình trạng giảm bạch cầu đa nhân trung tính, có thể thấy bắt thuốc dạng vòng tăng tín hiệu trên hình ảnh thì động mạch sớm có tiêm thuốc gadolinium. Áp xe do nấm cũng có thể cho thấy hạn chế khuếch tán trên xung DWI.
Hình 28. Nhiễm nấm Candida lan tỏa ở bệnh nhân bị giảm bạch cầu đa nhân trung tính có biểu hiện sốt 34 ngày sau khi ghép tế bào gốc tạo máu (hematopoietic stem cell transplant).
(a) Hình ảnh MRI T2W xóa mỡ (FS) trên mặt phẳng axial cho thấy nhiều nốt nhỏ tăng tín hiệu vừa phải rải rác khắp gan (các đầu mũi tên).
(b) Hình ảnh DWI mặt phẳng axial (b = 800 giây/mm2) cho thấy tăng tín hiệu của các ổ nhiễm nấm (các mũi tên) do có hạn chế khuếch tán nước (restricted water diffusion).
(c) Hình ảnh MRI T1W xóa mỡ (FS) trên mặt phẳng axial chỉ mô tả một số nốt lớn hơn dưới dạng các ổ giảm tín hiệu (các đầu mũi tên).
(d) Hình ảnh MRI T1W xóa mỡ (FS) có tiêm thuốc tương phản ở thì động mạch trên mặt phẳng axial cho thấy nhiều nốt bắt thuốc có giới hạn không rõ ở gan (các mũi tên). Hình ảnh CT hoặc MRI ở thì động mạch có thể mô tả nhiều tổn thương hơn ở giai đoạn sớm hơn, đặc biệt là trước khi hình thành ổ (nidus) hoại tử ở trung tâm.
Bệnh nấm Histoplasma (Histoplasmosis)
Bệnh nấm Histoplasma (Histoplasmosis) là một bệnh nhiễm nấm địa phương (endemic) phổ biến, đặc biệt ở các thung lũng sông Ohio, Missouri và Mississippi của Hoa Kỳ. Tổn thương gan được thấy trong 90% các trường hợp bệnh nấm Histoplasma lan tỏa. Các bệnh nhân có nguy cơ phát triển bệnh nấm lan tỏa bao gồm bệnh nhân nhiễm HIV với số lượng tế bào CD4 < 200 tế bào/mL, bệnh nhân bị suy giảm miễn dịch nguyên phát hoặc các rối loạn ức chế miễn dịch khác, và bệnh nhân đang dùng thuốc ức chế miễn dịch. Việc chẩn đoán có thể được xác định bằng nuôi cấy, phát hiện kháng nguyên, hoặc xét nghiệm kháng thể, nhưng hiệu quả của các phương pháp này không tối ưu và thường cần phải xác nhận mô học.
Các dấu hiệu hình ảnh của nhiễm nấm Histoplasma ở gan cũng tương tự như những dấu hiệu thấy ở nhiễm nấm candida hoặc các bệnh nấm lan tỏa khác, với nhiều tổn thương nhỏ khắp nhu mô gan. Lách cũng gần như luôn bị ảnh hưởng. Các thuốc kháng nấm, bao gồm amphotericin B cho các trường hợp nặng và itraconazole cho bệnh ở mức độ trung bình, được sử dụng để điều trị nhiễm nấm Histoplasma ở gan.
Chẩn đoán phân biệt của nhiễm nấm ở gan và các cạm bẫy tiềm ẩn
Chẩn đoán phân biệt của bệnh nấm lan tỏa (disseminated fungal disease) có liên quan đến gan bao gồm các bệnh nhiễm trùng khác như bệnh lao lan tỏa (disseminated tuberculosis) và bệnh Bartonella ở gan lách (hepatosplenic bartonellosis), lymphoma, bệnh bạch cầu (leukemia), di căn (metastases) và bệnh sarcoidosis. Chỉ riêng các dấu hiệu hình ảnh có thể không giúp phân biệt các tổn thương này. Tuy nhiên, ở những bệnh nhân bị giảm bạch cầu đa nhân trung tính, bệnh nấm phải được xem xét để hướng dẫn chăm sóc bệnh nhân thích hợp.
Kết luận
Vai trò của chẩn đoán hình ảnh là rất quan trọng trong các bệnh lý gan nhiễm trùng (infectious liver diseases). Tùy thuộc vào tác nhân gây bệnh (causative agent), hình ảnh cho phép phát hiện bệnh sớm, giúp loại trừ các tình trạng khác có biểu hiện lâm sàng tương tự, và hỗ trợ chẩn đoán xác định, từ đó hướng dẫn chăm sóc bệnh nhân thích hợp.
Mặc dù các dấu hiệu siêu âm thường không đặc hiệu, nhưng các dấu hiệu hình ảnh trên CT và đặc biệt là MRI, cùng với dữ liệu lâm sàng có thể cung cấp thông tin hữu ích để thu hẹp chẩn đoán phân biệt, loại trừ các khối u gan trong những trường hợp khó khăn, và đôi khi xác định tác nhân gây nhiễm trùng tiềm ẩn (Hình 29). Hơn nữa, siêu âm và CT là những phương tiện quan trọng để hướng dẫn chọc hút (aspiration) hoặc dẫn lưu (drainage) qua da khi cần thiết.
Hiểu biết về dịch tễ học, cơ chế bệnh sinh, biểu hiện lâm sàng, đặc điểm hình ảnh, và điều trị các bệnh nhiễm trùng gan có thể hỗ trợ trong chẩn đoán hình ảnh và hướng dẫn chăm sóc bệnh nhân thích hợp. Việc nhận thức được những cạm bẫy tiềm ẩn trong việc diễn giải hình ảnh có thể giúp tránh các xét nghiệm, thủ thuật và phương pháp điều trị không cần thiết.
Hình 29. Sơ đồ cho thấy chẩn đoán phân biệt khi có nghi ngờ về lâm sàng hoặc hình ảnh đối với bệnh lý gan nhiễm trùng (infectious liver disease). DWI = diffusion-weighted images, TB = bệnh lao (tuberculosis). (Xin xem hình trên tài liệu tiếng Anh để thấy rõ hơn).
Tài liệu tham khảo
Người dịch: Bs Lê Thị Ny Ny – Anhvanyds
Để lại một phản hồi Hủy