Hẹp động mạch cảnh (Carotid artery stenosis) là nguyên nhân chính gây bệnh tật và tử vong.
Đối với động mạch cảnh trong (ICA), việc đánh giá mức độ hẹp lòng mạch dựa vào việc đo đạc trên siêu âm sẽ dựa vào hai mô hình là NASCET (North American Symptomatic Carotid Endarterectomy Trial) của Bắc Mỹ và mô hình ECST (European Carotid Surgery Trial) của Châu Âu.
1. Mô hình NASCET
* Đối với mô hình NASCET, cách đo đạc gồm: đo đường kính hẹp nhất tại vị trí hẹp động mạch cảnh trong (ICA); và đo đường kính bình thường của ICA nằm xa hành cảnh của ICA, nơi mà thành động mạch song song nhau và không bị ảnh hưởng bởi mảng xơ vữa động mạch. Mức độ hẹp được tính toán bằng công thức sau:
+ Mức độ hẹp (%) = [1 − (Đường kính lòng mạch nhỏ nhất/Đường kính bình thường của động mạch cảnh trong đoạn xa)] × 100
Theo tiêu chuẩn của NASCET, hẹp động mạch được phân loại là hẹp nhẹ (<30%), trung bình (30–69%) hoặc nặng (70–99%). Tắc nghẽn hoàn toàn (Complete occlusion) được xác định khi mức độ hẹp là 100%. Tiếp theo, nhóm hẹp trung bình được chia nhỏ thành hẹp trung bình mức độ thấp (low-moderate) (30–49%) và hẹp trung bình mức độ cao (high-moderate) (50–69%).
2. Mô hình ECST
– Đối với mô hình ECST, việc tính toán mức độ hẹp lòng mạch được thực hiện bằng cách so sánh đường kính hẹp nhất của đoạn mạch bị tổn thương với đường kính gốc (nguyên thủy) tại hành cảnh của ICA tại vị trí có mảng xơ vữa theo công thức sau:
Mức độ hẹp (%) = [1 − (Đường kính lòng mạch nhỏ nhất/đường kính ước tính tại hành cảnh của ICA)] × 100
Đối với ECST, 70–99% được định nghĩa là hẹp nặng, 30–69% là hẹp trung bình và 0–29% là hẹp nhẹ.
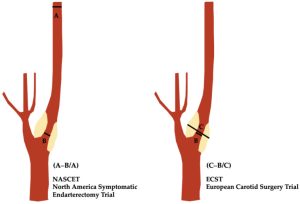
Hình minh họa sơ đồ hẹp động mạch cảnh trong (ICA), thể hiện các phương pháp đo NASCET và ECST.
B, đường kính lòng mạch tại vị trí hẹp nhất.
A, đường kính của đoạn xa ICA bình thường nằm ngoài hành cảnh (bulb), vị trí mà thành động mạch song song nhau.
C, đường kính ước tính chiều rộng ban đầu (original width) của ICA tại vị trí hẹp nhất.
Dựa trên các công thức, rõ ràng là bất kỳ mức độ hẹp nào được tính toán theo phương pháp ECST đều sẽ cho ra tỷ lệ phần trăm mức độ hẹp nhiều hơn, vì nó được so sánh với khẩu kính thực tế của hành cảnh (bulb) thay vì so sánh với đoạn động mạch cảnh trong (ICA) không bị tổn thương nằm phía sau hành cảnh theo phương pháp NASCET.
Bảng 1: Mối quan hệ giữa ECST và NASCET (% hẹp). Thang chuyển đổi dựa trên các phương trình sau: NASCET = (ECST − 40) %/0.6 và ECST = 40 + (0.6 × NASCET %).
Mức độ hẹp 70% theo tiêu chuẩn ECST tương ứng với mức độ hẹp khoảng 50% theo tiêu chuẩn NASCET, trong khi mức độ hẹp 70% theo NASCET lại tương ứng với mức độ hẹp khoảng 80% theo ECST.
Khi sử dụng siêu âm, việc đánh giá theo tiêu chuẩn NASCET đặt ra nhiều khó khăn trong thực hành lâm sàng, cụ thể là: vị trí chia đôi động mạch nằm ở cao, mạch máu xoắn vặn nhiều, mảng xơ vữa quá dài và huyết khối cấp tính; trong đó huyết khối cấp tính có thể khó thấy trên hình ảnh chế độ B-mode vì chúng có độ hồi âm rất kém.
Để giải quyết những khó khăn này, công nghệ siêu âm, đặc biệt là việc đo vận tốc đỉnh tâm thu (PSV) tại vị trí hẹp, đã được nghiên cứu như một thông số thay thế để đánh giá tình trạng hẹp động mạch cảnh. PSV, một phép đo siêu âm Doppler đại diện cho vận tốc dòng máu cao nhất trong thì tâm thu, được thực hiện bằng cách đặt đầu dò Doppler lên động mạch cảnh và đo vận tốc dòng máu tại vị trí hẹp nhất. Cơ sở lý luận của việc sử dụng PSV làm marker thay thế dựa trên nguyên lý là khi lòng động mạch bị hẹp lại (narrows) do hẹp mạch (stenosis), vận tốc dòng máu sẽ tăng lên. Do đó, giá trị PSV càng cao thường cho thấy mức độ hẹp càng nặng.
Bảng 2: Sự tương quan giữa phương pháp NASCET và siêu âm.
Ví dụ, vận tốc đỉnh tâm thu (PSV) > 230 cm/s của ICA thường được coi là dấu hiệu của tình trạng hẹp từ 70% trở lên theo tiêu chuẩn NASCET.
Tuy nhiên, điều quan trọng là phải thừa nhận rằng mối liên quan này chỉ là gián tiếp. Các phép đo PSV không cung cấp đánh giá về mặt hình thái đúng theo các quy tắc của NASCET, quy tắc mà vốn yêu cầu cụ thể việc quan sát trực tiếp các đoạn động mạch nhất định.
Việc phụ thuộc vào PSV như một chỉ số thay thế cho tình trạng hẹp động mạch cảnh dẫn đến một số hạn chế. Thứ nhất, các phép đo PSV có thể bị ảnh hưởng bởi những yếu tố khác ngoài mức độ hẹp. Sự thay đổi về cung lượng tim, huyết áp, và thậm chí là tình trạng tắc động mạch cảnh bên đối diện cũng có thể ảnh hưởng đến kết quả đo PSV. Một hạn chế khác là khả năng xảy ra sự khác nhau giữa các bác sĩ siêu âm trong việc đo đạc PSV. Siêu âm phụ thuộc vào người làm, và các khác biệt trong việc đặt đầu dò, góc quét (angle of insonation), cũng như cách diễn giải kết quả có thể dẫn đến sự không đồng nhất trong các phép đo. Sự thiếu nhất quán này có thể gây ra vấn đề, đặc biệt là khi đưa ra các quyết định lâm sàng quan trọng dựa trên những giá trị này.
Hơn nữa, nếu chỉ sử dụng PSV như một phép đo đơn lẻ thì sẽ không thể cung cấp một bức tranh đầy đủ về các đặc điểm hình thái của tổn thương hẹp. Những thông tin về thành phần mảng xơ vữa, đặc điểm bề mặt và sự hiện diện của vết loét mảng xơ vữa – vốn là những yếu tố thiết yếu để đánh giá nguy cơ đột quỵ và định hướng điều trị – đều không thể nhận thấy được nếu chỉ dựa vào các phép đo PSV.
Việc dựa vào PSV cũng gây ra nguy cơ đơn giản hóa quá mức. Hẹp động mạch cảnh (Carotid stenosis) là bệnh lý phức tạp, và việc đánh giá nó với một thông số huyết động duy nhất có thể bỏ qua sự hiểu biết cặn kẽ cần thiết để quản lý bệnh nhân tối ưu.
Do đó, phép đo PSV là phương pháp không xâm lấn, dễ tiếp cận và nhanh chóng để đánh giá hẹp động mạch cảnh và có giá trị quan trọng trong kỷ nguyên chụp mạch máu (angiography) có liên quan đến nguy cơ đột quỵ chu phẫu (perioperative stroke); ngày nay, với kỹ thuật chụp mạch máu được thay thế bằng CTA có độ chính xác cao, nhanh chóng, không có nguy cơ đột quỵ, các bằng chứng thống kê của PSV mà không thực hiện chụp mạch máu (angiography) dường như đã lỗi thời để định lượng mức độ hẹp thay thế cho chụp mạch máu (angiography).
Mảng xơ vữa động mạch cảnh dễ tổn thương (Carotid Vulnerable Plaque)
Vào tháng 10 năm 2023, hệ thống Carotid Plaque RADS đã được giới thiệu. Đây là hệ thống báo cáo tính điểm dựa trên đa phương thức chẩn đoán hình ảnh đáng tin cậy, giúp:
(1) dự báo nguy cơ xảy ra các biến cố mạch máu não (cerebrovascular events) dựa trên hình thái mảng xơ vữa động mạch cảnh,
(2) tạo điều kiện thuận lợi cho việc khai thác dữ liệu và nghiên cứu nhờ vào hệ thống thuật ngữ chuẩn hóa.
Hệ thống Carotid Plaque RADS (Hình 6) xem xét các yếu tố sau:
+ Các đặc điểm hình ảnh (Imaging features): Độ dày thành mạch lớn nhất (MWT – maximum wall thickness), lõi hoại tử giàu lipid (LRNC – lipid-rich necrotic core), xuất huyết trong mảng xơ vữa (IPH – intraplaque hemorrhage), nứt vỡ lớp vỏ sợi (FC – fibrous cap (FC) rupture) và huyết khối trong lòng mạch (intraluminal thrombus);
+ Các đặc điểm phụ (Ancillary features): Tình trạng viêm và tân sinh mạch máu (neovascularization) trong mảng xơ vữa, tái cấu trúc động mạch cảnh dương tính (positive carotid remodeling), gánh nặng mảng xơ vữa (plaque burden), sự tiến triển của tình trạng hẹp và vôi hóa mảng xơ vữa động mạch cảnh;
+ Các yếu tố hiệu chỉnh (Modifiers): Xét nghiệm hình ảnh chẩn đoán bị hạn chế (L), sự hiện diện của stent và tiền sử phẫu thuật cắt lớp nội mạc động mạch cảnh (CEA) trước đó.
Hình 6. Sơ đồ minh họa các loại RADS khác nhau của mảng xơ vữa động mạch cảnh (Carotid Plaque RADS) từ 1 đến 4, các đặc điểm phụ trợ và các yếu tố hiệu chỉnh.
Normal vessels with normal vessel walls and absence of plaque define plaque-RADS 1.
MWT < 3 mm, without imaging features of complicated plaques, defines plaque-RADS 2, which is a relatively stable plaque and therefore a low-risk plaque, mainly consisting of fibrous tissue, small lipid pools, and a small lipid-rich necrotic core (LRNC), but also a potential precursor of complicated plaques, should its components modify over time.
In plaque-RADS 3, there is an MWT ≥ 3 mm, a moderate-to-large LRNC, calcifications, healed ulcerations, and calcifications. The subcategories 3a, 3b, and 3c are defined by the presence of thick FC, thin FC, and plaque ulceration, respectively. LRNC has been associated with an increased risk of future ipsilateral cerebrovascular events in a meta-analysis by Gupta et al.
IPH, characteristic of category 4 and first reported by Moody et al. in 1999, is the most common feature of complicated plaques. It has been object of extensive research, being present in 89% of all complicated plaques ipsilateral to acute ischemic stroke as demonstrated by Kopczak and colleagues and associated with recurrent stroke, as indicated by the recent prospective Plaque at Risk (PARISK) study.
Fibrous cap (FC) rupture, which is present in categories 4b and 4c, forms part of a dynamic process along with thrombus formation, healing, and remodeling of the plaque, and is also linked to cerebrovascular events.
The intraluminal thrombus, defining category 4c, is a recognized predictor of stroke of carotid origin and is found in up to 92% of patients with neurologic symptoms.
The ancillary features represent validated features of plaque instability that do not determine the main Plaque-RADS score but can represent a complementary tool if present. These include inflammatory changes in the perivascular fat, carotid artery remodeling, plaque burden, progression of stenosis, and carotid plaque calcification, in particular the positive rim sign.
The modifiers, as in CAD-RADS, can be complemented to indicate the situation where the study is not fully diagnostic, or where the presence of metal-induced artifacts may influence the correct assessment of the carotid plaque morphology.
US can evaluate intima-media thickness (IMT), wall thickness, plaque volume, and thick fibrous cap (FC), the latter presenting as an hyperechoic structure and being the hallmark of the score 3a.
The echogenicity of LRNC cannot be distinguished from IPH on US, and so-called juxta-luminal black areas (JBA), consisting of LRNC with a thin FC and defining score 3b, can also be due to plaque rupture (score 4b) or intraluminal thrombus (score 4c).
As a result, US is sufficiently diagnostic for the plaque-RADS categories 1, 2, and 3a; however, if a hypoechoic plaque without a visible hyperechoic FC or a JBA is seen on US, additional imaging is required. In this context, MRI is preferred since it is widely accepted that, given the overlapping HU, CT cannot adequately differentiate between LRNC and IPH; nor can it determine FC thickness and/or integrity.
On MRI, IPH is identified as a focus of hyperintensity in the context of the plaque on heavily T1- weighted images, with an inversion pre-pulse to suppress the signal of blood show (MPRAGE), while FC thickness is detected on time-of-flight (TOF) images as a band of low signal, if present.
Each imaging modality, US, CT, or MRI, has its limitations.
US is operator-dependent and is limited by the presence of shadowing due to calcifications and patient-related anatomical considerations.
CT, besides the well-known exposure to ionizing radiation and adverse reactions to the iodinated contrast medium, cannot distinguish completely between IPH, LRNC, and fibrous tissue due to overlapping Hounsfield Units (HU).
Lastly, MRI is limited due to its extended acquisition periods, low availability, and requirement for specialized coils.
Bài trên là lược dịch, xin đọc thêm đầy đủ bài gốc ở tài liệu tiếng Anh dưới đây.
Người lược dịch: Bs Lê Thị Ny Ny – Anhvanyds
Để lại một phản hồi Hủy