Bệnh lý tim mạch (Cardiovascular disease) vẫn là nguyên nhân gây tử vong số 1 tại Hoa Kỳ, với bệnh động mạch vành (coronary artery disease) chiếm khoảng 425.400 ca tử vong vào năm 2006. Hướng dẫn (guideline) năm 2004 được công bố bởi một nhóm chuyên gia của Đại học Tim mạch Hoa Kỳ (ACC – American College of Cardiology) / Hiệp hội Tim mạch Hoa Kỳ (AHA – American Heart Association) đã khuyến cáo phẫu thuật bắc cầu nối động mạch vành (CABG – coronary artery bypass graft) trong điều trị bệnh nhân bị bệnh động mạch vành tiến triển như hẹp đáng kể thân chung động mạch vành trái (left main coronary artery stenosis), hẹp ≥ 70% ở đoạn gần của động mạch liên thất trước (LAD – left anterior descending) và đoạn gần của động mạch mũ trái (LCX), và bệnh động mạch vành 3 nhánh.
Hiện tại, có hơn 469.000 ca phẫu thuật bắc cầu nối động mạch vành (CABG) được thực hiện tại Hoa Kỳ hàng năm. Mục tiêu của CABG là phục hồi tưới máu cơ tim, điều này không chỉ làm giảm triệu chứng mà còn kéo dài tuổi thọ. Tuy nhiên, bệnh nhân thường có các triệu chứng tái phát liên quan đến hẹp (stenosis) hoặc tắc nghẽn (occlusion) các bắt cầu nối động mạch vành của họ.
Các yếu tố tiên lượng lâu dài cho khả năng sống sót sau tái thông mạch máu cơ tim (myocardial revascularization) phụ thuộc vào mức độ thông thoáng của cầu nối (bypass graft) và sự tiến triển tự nhiên của bệnh động mạch vành. Chụp mạch vành thông thường (Conventional angiography) được coi là tiêu chuẩn vàng (gold standard) trong đánh giá mức độ thông thoáng (patency) của các cầu nối động mạch vành (coronary bypass grafts), nhưng trong những năm gần đây, sự phát triển của chụp cắt lớp vi tính đa dãy đầu dò (MDCT) tinh vi đã cho phép tạo ra hình ảnh chính xác các cầu nối mà không xâm lấn. Các nghiên cứu được công bố gần đây đã khám phá tiềm năng chẩn đoán của các thế hệ máy CT khác nhau trong việc đánh giá mức độ thông thoáng và hẹp của cầu nối mạch vành (CABG).
Đánh giá mức độ thông thoáng của cầu nối mạch vành bằng máy chụp CT một lát cắt lần đầu tiên được mô tả vào những năm 1980. Những cải tiến về hiệu quả kỹ thuật với máy CT 4 và 16 lát cắt có gắn cổng ECG đã tiếp tục khẳng định vai trò của công nghệ này trong việc đánh giá các cầu nối mạch vành. Sự ra đời của máy MDCT 64 lát cắt với độ phân giải không gian và thời gian cao đã cho phép phát hiện tình trạng hẹp động mạch vành và cầu nối với độ dày lát cắt dưới milimét chỉ trong một lần nín thở.
Các ứng dụng đa mặt phẳng 3D tương tác hiện nay cho phép đánh giá chi tiết các cầu nối động mạch và tĩnh mạch cũng như các động mạch vành tự nhiên (native coronary arteries), bao gồm cả mức độ hẹp do các mảng xơ vữa động mạch vành gây ra. Cho đến nay, các nghiên cứu đã công bố về máy CT 64 lát cắt cho thấy độ nhạy và độ đặc hiệu lần lượt là từ 93.3% đến 100% và từ 91.4% đến 100% khi đánh giá tình trạng tắc nghẽn và hẹp đáng kể (>50%) của cầu nối mạch vành (CABG).
Một nghiên cứu gần đây của Liu và cộng sự đã đánh giá độ chính xác chẩn đoán của chụp cắt lớp vi tính mạch máu (CTA – CT angiography) 64 lát cắt trên 228 bệnh nhân sau phẫu thuật bắc cầu động mạch vành (CABG). Đối với việc phát hiện tình trạng hẹp cầu nối thì độ nhạy, độ đặc hiệu, giá trị tiên đoán dương, giá trị tiên đoán âm và độ chính xác lần lượt là 93.3%, 98.1%, 93.3%, 98.1%, and 97.1%. Đối với tình trạng tắc nghẽn cầu nối thì độ nhạy, độ đặc hiệu, giá trị tiên đoán dương, giá trị tiên đoán âm và độ chính xác lần lượt là 96.4%, 98.1%, 96.4%, 98.1%, and 97.6%.
Protocol chụp cắt lớp vi tính đa dãy đầu dò (MDCT)
Nhiều protocol chụp khác nhau được sử dụng thường quy trong lâm sàng để thực hiện đánh giá không xâm lấn cầu nối mạch vành (CABG) bằng máy chụp CT đa dãy đầu dò (MDCT). Hiệu quả chẩn đoán của CTA động mạch vành dựa vào các nghiên cứu kỹ thuật thành thạo và các thông số hình ảnh được tối ưu hóa, bao gồm thời gian chụp và tái tạo hình ảnh.
Trong đánh giá động mạch vành, điều quan trọng là phải biết bản chất của quy trình phẫu thuật trước đó để xác định trường chụp. Ví dụ, đánh giá mức độ thông thoáng của cầu nối tĩnh mạch hiển (SVG – saphenous vein graft) nên mở rộng từ đoạn giữa của động mạch chủ lên (ascending aorta) đến đáy tim (base of the heart), trong khi chụp hình cầu nối động mạch vú trong (internal mammary graft) bao gồm từ vị trí xuất phát của mạch máu tại động mạch dưới đòn (subclavian artery) đến mỏm tim (cardiac apex). Bệnh nhân được chụp ở tư thế nằm ngửa (supine position) theo hướng từ đầu đến chân (craniocaudal direction) trong một lần nín thở. Tại một số cơ sở, phương pháp chụp hướng từ chân lên đầu được sử dụng với máy CT 64 lát cắt để giảm thiểu cử động hô hấp trong quá trình thu nhận hình ảnh tim.
Đối với chụp CTA mạch vành, việc tiêm tĩnh mạch thuốc tương phản chứa i-ốt không ion hóa qua kim luồn tĩnh mạch (angiocatheter) cỡ 18 hoặc 20 gauge vào tĩnh mạch vùng khuỷu tay là đủ, tùy thuộc vào tốc độ tiêm tĩnh mạch. Thời gian tiêm bolus tự động được thực hiện khi đậm độ thuốc tương phản trong động mạch chủ xuống (descending aorta) đạt đến một ngưỡng xác định trước (thường là 1100 HU) với độ trễ từ 5 đến 10 giây trước khi bắt đầu chụp, để tối ưu hóa hình ảnh tốt hơn của thất trái, các động mạch vành, và các cầu nối mạch vành. Ngoài ra, có thể thực hiện một liều bolus thử nghiệm (test bolus).
Thuốc chẹn beta (b-Blockade) được dùng bằng đường uống hoặc tiêm tĩnh mạch (ví dụ: metoprolol) trước khi chụp CTA để đạt được nhịp tim < 70 nhịp/phút và để giảm thiểu các ảnh giả chuyển động của tim (cardiac motion artifacts). Ngoài ra, hình ảnh thu được với một lần nín thở ở giữa thì hít vào để giảm tình trạng không đồng nhất của thuốc tương phản trong nhĩ phải do dòng máu không chứa thuốc tương phản từ tĩnh mạch chủ dưới (IVC) đi vào.
Trong chụp cắt lớp vi tính mạch máu đa dãy đầu dò (MDCT angiography) có gắn cổng ECG (ECG gating) thường được thực hiện bằng việc sử dụng cổng hồi cứu (retrospective gating) để tạo ra các hình ảnh tối ưu cho việc tái tạo (reconstruction) ở các giai đoạn khác nhau của chu kỳ tim. Các lát cắt theo mặt phẳng axial của tim được tái tạo bằng cách sử dụng 60% đến 80% của khoảng R–R, với các hình ảnh dày 0.9 mm được tái tạo theo bước nhảy (increments) 0.45 mm (tùy thuộc vào protocol chụp được sử dụng), cùng với hình ảnh tái tạo thể tích (VR) 3D và hình ảnh tái tạo đa mặt phẳng (MPR). Các cầu nối mạch vành (CABG) bao gồm cả chỗ nối (anastomosis) ở đoạn gần và đoạn xa cũng như giải phẫu bề mặt tim (cardiac topography) được đánh giá bằng việc sử dụng hình ảnh tái tạo thể tích (VR) 3D, trong khi hình ảnh tái tạo đa mặt phẳng (MPR) và hình ảnh cường độ tối đa (MIP) được sử dụng để đánh giá bệnh động mạch vành.
Giải phẫu cầu nối mạch vành (CABG)
Hiểu biết về giải phẫu cầu nối mạch vành (CABG) và quy trình phẫu thuật bắc cầu mạch vành là rất quan trọng trong việc đánh giá mức độ thông thoáng của cầu nối. Cầu nối động mạch vú trong trái (LIMA) và cầu nối tĩnh mạch hiển (SVG) là những loại cầu nối phổ biến nhất. Trong số đó, các cầu nối động mạch mang lại mức độ thông thoáng tốt hơn và lâu dài hơn so với các cầu nối tĩnh mạch hiển. Các mạch máu khác bao gồm động mạch quay (radial arteries), động mạch vị mạc nối phải (R-GEA: right gastroepiploic artery) và động mạch thượng vị dưới (inferior epigastric artery) thì ít được sử dụng hơn.
Đánh giá CTA ban đầu sau khi phẫu thuật bắc cầu mạch vành (CABG) tập trung vào loại cầu nối (graft type), nguyên ủy (origin), đường đi (course) và chỗ nối (anastomosis). Hình thái và mức độ thông thoáng của cầu nối sau đó được đánh giá bằng thuốc tương phản. Các cầu nối mạch vành (CABG) được chia thành 3 đoạn: (1) nguyên ủy hoặc đoạn trước chỗ nối; (2) thân của cầu nối; và (3) đoạn sau chỗ nối. Đoạn trước chỗ nối (proximal anastomosis) được hiển thị rõ hơn trên CTA so với đoạn sau chỗ nối (distal anastomosis) vì đoạn sau chỗ nối dễ bị ảnh giả do chuyển động hơn. Đoạn sau chỗ nối (distal anastomosis) không được thấy rõ và được xem là thông thoáng (patent) khi có thuốc tương phản bên trong lòng cầu nối.
Cầu nối tĩnh mạch hiển (saphenous vein grafts)
Tĩnh mạch hiển (saphenous vein) lần đầu tiên được sử dụng trong phẫu thuật bắc cầu mạch vành (CABG) vào cuối những năm 1960. Việc sử dụng tĩnh mạch hiển để tái thông (revascularization) động mạch vành mang lại nhiều lợi ích bao gồm tính sẵn có (availability), dễ tiếp cận (accessibility), dễ lấy (ease of harvest) và khả năng chống co thắt mạch (resistance to spasm). Tuy nhiên, phương pháp sử dụng tĩnh mạch hiển bị hạn chế bởi tỷ lệ tăng sản nội mạc tân sinh (neointimal hyperplasia) và hình thành xơ vữa động mạch (atherosclerosis) cao hơn sau khi tiếp xúc với áp lực máu toàn thân và thiếu hụt sản xuất oxit nitric khi so sánh với các cầu nối động mạch.
Ngoài ra, tình trạng giãn tĩnh mạch (varicosity) và xơ cứng thành mạch (sclerotic) làm hạn chế việc sử dụng tĩnh mạch hiển làm ống ghép. Tắc nghẽn sớm của tĩnh mạch hiển có thể do các kỹ thuật phẫu thuật được sử dụng khi lấy mạch máu (tổn thương nội mô), quy trình bảo quản, hoặc chấn thương cơ học. Các nghiên cứu gần đây đã báo cáo rằng khoảng 15% đến 20% cầu nối tĩnh mạch bị tắc nghẽn trong năm đầu tiên. Tỷ lệ tắc nghẽn cầu nối sau đó là 1% đến 2% trong khoảng từ 1 đến 6 năm và 4% đến 5% trong khoảng từ 6 đến 10 năm. Tỷ lệ thông thoáng sau 10 năm đối với cầu nối tĩnh mạch hiển (SVG) là khoảng 60%, và chỉ 50% trong số các cầu nối tĩnh mạch này là không bị hẹp. Thuốc chống kết tập tiểu cầu (Antiplatelet therapy) và thuốc hạ lipid máu giúp giảm tỷ lệ tắc nghẽn của cầu nối tĩnh mạch hiển.
Cầu nối tĩnh mạch hiển (SVG) đoạn gần thường được nối vào thành trước động mạch chủ lên và đoạn xa được nối vào phía dưới chỗ hẹp hoặc tắc nghẽn (Hình 1 và 2). Đối với các cầu nối tái thông cho vùng cấp máu của động mạch liên thất trước (LAD) hoặc động mạch mũ trái (LCX), đoạn gần của chỗ nối (proximal anastomosis) được nối vào bên trái động mạch chủ và được cố định trên động mạch phổi chính (main pulmonary artery).
Trong trường hợp các cầu nối bên phải đến vùng cấp máu của động mạch vành phải (RCA), tĩnh mạch hiển được nối vào phía bên phải của động mạch chủ, và đi theo hướng về phía rãnh nhĩ thất phải (right arterioventricular groove). Cầu nối tĩnh mạch hiển (SVG) có thể được nối trực tiếp vào động mạch chủ bằng chỉ khâu (sutures) hoặc bằng thiết bị nối mạch máu trong lòng mạch (intraluminal anastomosis device) giúp nối nhanh hơn mà không cần chỉ khâu và không cần kẹp các mạch máu đích (target vessels). Với hệ thống nối vào động mạch chủ, cầu nối tĩnh mạch đoạn gần được nối một góc 90 độ vào phía bên trái của động mạch chủ và được cố định trên động mạch phổi chính.
Cầu nối tĩnh mạch hiển (SVG) thường có đường kính lớn hơn so với các động mạch vành tự nhiên hoặc các cầu nối động mạch trên hình chụp CTA mạch vành. Để tái thông mạch cho động mạch vành phải (RCA), động mạch liên thất sau (PDA), hoặc đoạn xa của động mạch liên thất trước (LAD) thì cầu nối tĩnh mạch hiển (SVG) đoạn gần được nối vào phía bên phải. Sau đó, cầu nối tĩnh mạch hiển đoạn xa được nối vào RCA, PDA hoặc đoạn xa của LAD trong trường hợp thông nối bên phải (right-sided anastomosis). Đoạn xa của cầu nối có thể nằm trên mặt hoành của tim. Trong trường hợp thông nối bên trái (left-sided anastomosis), cầu nối tĩnh mạch hiển (SVG) đoạn xa thường được nối vào động mạch liên thất trước (LAD), động mạch chéo (diagonal artery), động mạch mũ trái (LCX), hoặc các động mạch bờ tù (OM – obtuse marginal arteries).
Trong những trường hợp cầu nối tĩnh mạch hiển (SVG) được ghép vào hơn hai động mạch vành thì kỹ thuật phẫu thuật nối mạch máu tận-bên (end-to-side) và bên-bên (side-to-side) được sử dụng. Các động mạch vành tự nhiên có đường kính nhỏ hơn nằm sau chỗ nối cũng nên được đánh giá sự thông thoáng (patency). Khác với cầu nối động mạch, thì cầu nối tĩnh mạch hiển (SVG) ít bị ảnh giả dạng vệt (streak artifacts) do clip phẫu thuật hơn.
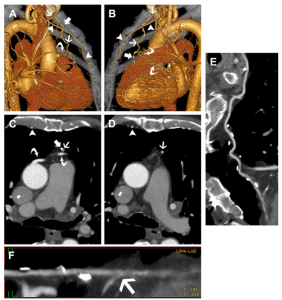
Hình 1. Bệnh nhân nam 89 tuổi đã chụp cắt lớp vi tính mạch vành (CTA) để đánh giá sự thông thoáng của cầu nối mạch vành (CABG).
(A, B) Hình ảnh tái tạo thể tích (VR) 3D cho thấy hình ảnh điển hình của cầu nối tĩnh mạch hiển bên phải (mũi tên cong màu đen) được khâu vào thành trước phải của động mạch chủ lên và nối với động mạch liên thất sau (PDA) (không hiển thị ở đây), và cầu nối tĩnh mạch hiển bên trái (các mũi tên cong màu trắng) được khâu vào thành trước trái động mạch chủ lên và nối với nhánh bờ tù (OM branch) của động mạch mũ trái. Động mạch vú trong trái (LIMA) (mũi tên) được nối vào động mạch liên thất trước (LAD) bằng nhiều clip phẫu thuật (surgical clips) (các mũi tên đặc) nằm cạnh động mạch. Động mạch vú trong phải (RIMA) (các đầu mũi tên) ở vị trí bình thường nằm sát xương ức.
(C, D) Hình ảnh CTA mạch vành trên mặt phẳng axial cho thấy cầu nối động mạch vú trong trái (LIMA) có bắt thuốc tương phản (mũi tên) kèm với một clip phẫu thuật (mũi tên đặc) nằm cạnh động mạch. Đoạn gần của cầu nối tĩnh mạch hiển (các mũi tên cong) bao gồm cả chỗ nối (anastomosis) cũng được thuốc tương phản lấp đầy tốt. Động mạch vú trong phải (RIMA) cho thấy sự bắt thuốc và vị trí bình thường.
(E) Hình ảnh tái tạo đa mặt phẳng dạng đường cong (Curved MPR) của cầu nối động mạch vú trong trái (LIMA) cho thấy cầu nối thông thoáng với nhiều clip phẫu thuật được sử dụng để thắt lại các nhánh bên.
(F) Hình ảnh tái tạo dạng đường thẳng (Linear reformatted image) của đoạn xa động mạch vú trong trái (LIMA) cho thấy chỗ nối tận-bên (end-to-side anastomosis) (mũi tên) với đoạn xa động mạch liên thất trước (LAD). Mặc dù chỗ nối không được bắt thuốc tương phản rõ, nhưng việc bắt thuốc tương phản ở đoạn trước chỗ nối nên việc tắc nghẽn ở đoạn sau chỗ nối là khó có thể xảy ra.
Cầu nối động mạch vú trong (internal mammary artery grafts)
Động mạch vú trong (IMA – internal mammary artery) đã trở thành ống dẫn (conduit) được lựa chọn để tái thông mạch cho các động mạch vành bị tắc nghẽn. Các nghiên cứu gần đây đã chỉ ra rằng cầu nối động mạch vú trong (IMA) có tỷ lệ thông thoáng lâu dài vượt trội so với cầu nối tĩnh mạch hiển (SVG) và chống lại tình trạng xơ vữa động mạch tốt hơn. Một ưu điểm khác so với cầu nối tĩnh mạch hiển (SVG) là nội mô của động mạch vú trong (IMA) sản xuất ra prostacyclin và các yếu tố giãn mạch (như oxit nitric) khi đáp ứng với các kích thích vận mạch (vasoactive stimuli).
Ngoài ra, các đặc điểm sinh học của động mạch vú trong (IMA) bao gồm lớp đàn hồi trong (internal elastica lamina) không có các lỗ nhỏ nên giúp ngăn ngừa sự di chuyển của tế bào và tăng sản nội mạc (intimal hyperplasia). Cấu trúc thành mạch của cầu nối động mạch cũng phù hợp hơn với hệ thống áp lực cao và vận tốc dòng chảy cao sau khi phẫu thuật bắc cầu động mạch vành. Các nghiên cứu chỉ ra rằng cầu nối động mạch vú trong (IMA) ít có khả năng gây ra các biến chứng và tử vong sau phẫu thuật hơn và có tỷ lệ thông thoáng lâu dài lớn hơn 90% sau 10 năm.
Do vị trí giải phẫu nên động mạch vú trong trái (LIMA) thường được coi là cầu nối được lựa chọn để tái thông mạch cho động mạch liên thất trước (LAD) hoặc động mạch chéo (diagonal artery). Cầu nối này thường được sử dụng tại chỗ (in situ) từ vị trí xuất phát đoạn gần của LIMA tại động mạch dưới đòn trái (left subclavian) với đoạn xa nối vào bên dưới động mạch liên thất trước (LAD) hoặc các nhánh chéo diagonal bị tắc nghẽn (xem Hình 1 và 2). Việc nối đoạn xa của LIMA tuần tự với các kiểu nối bên-bên (side-to-side) hoặc tận-bên (end-to-side) đôi khi được thực hiện giữa các nhánh của cùng một động mạch vành bao gồm LAD và các nhánh chéo nằm kế cận nhau hoặc cả hai kiểu nối trên LAD. Cầu nối động mạch vú trong (IMA) thường được thấy dưới dạng một mạch máu chạy dọc theo trung thất trước bên trái trên hình chụp CTA và có thể khó thấy đoạn xa do ảnh giả của các clip phẫu thuật.
Động mạch vú trong phải (RIMA) ít được sử dụng tại chỗ hơn để tái thông mạch cho vùng cấp máu của động mạch vành phải (RCA) hoặc hệ thống động mạch vành bên trái. Nếu động mạch vú trong phải (RIMA) được nối với các nhánh chéo diagonal hoặc các nhánh bờ tù (OM) của động mạch mũ trái thì RIMA sẽ được đưa qua xoang ngang (transverse sinus) của màng ngoài tim (pericardium) vì kỹ thuật này đã được chứng minh là có liên quan đến tỷ lệ thông thoáng được cải thiện.
Động mạch vú trong phải (RIMA) cũng có thể được sử dụng như một cầu nối tự do (free graft) hoặc cầu nối tổng hợp (composite graft). Khi là cầu nối tự do (free graft), RIMA đoạn gần được nối vào động mạch chủ lên và đoạn xa nối vào động mạch vành bị tắc nghẽn. Ngoài ra, khi là cầu nối tổng hợp (composite graft), RIMA đoạn gần được nối vào động mạch vú trong trái (LIMA) và đoạn xa nối vào vùng cấp máu của động mạch mũ trái (LCX) theo cấu hình chữ Y (Y configuration) giúp tái thông động mạch cơ tim toàn bộ.
Việc sử dụng động mạch vú trong trái (LIMA) để làm cầu nối cho hệ thống động mạch liên thất trước (LAD) và động mạch mũ trái (LCX) trong trường hợp bệnh lý hai mạch máu (double-vessel disease) giúp tránh phải lấy thêm cầu nối thứ hai. Một ưu điểm khác của kỹ thuật ống ghép chữ Y (Y-graft) là cầu nối có thể được gắn gần hơn với LAD so với cầu nối tuần tự (sequential graft) giúp tăng chiều dài khả dụng (available length) của động mạch vú trong trái (LIMA). Các nghiên cứu đã chứng minh rằng việc sử dụng cả hai động mạch vú mang lại tỷ lệ tái phát đau thắt ngực thấp hơn và tỷ lệ thông thoáng cầu nối sau 1 năm được cải thiện khi so sánh với việc sử dụng động mạch vú trong trái (LIMA) kết hợp với cầu nối tĩnh mạch hiển (SVG).
Hình 2. Bệnh nhân nam 91 tuổi đã chụp CTA mạch vành để đánh giá sự thông thoáng của cầu nối mạch vành (CABG).
(A, B) Hình ảnh tái tạo thể tích (VR) 3D cho thấy hình ảnh điển hình của cầu nối tĩnh mạch hiển trái (SVG) (các đầu mũi tên trắng) được khâu vào thành trước trái động mạch chủ lên và nối với nhánh bờ tù (OM) của động mạch mũ trái (đầu mũi tên đen) và cầu nối động mạch vú trong trái (LIMA) (các mũi tên đặc màu trắng) được khâu vào thành trước trái động mạch chủ lên và nối với động mạch liên thất trước (LAD) (mũi tên đặc màu đen) với nhiều clip phẫu thuật. Cầu nối động mạch quay (RA) (các mũi tên) được nối vào bên phải động mạch chủ lên và nối với động mạch liên thất sau (PDA) (không hiển thị ở đây).
(C) Hình ảnh tái tạo đa mặt phẳng dạng đường cong (Curved MPR) của cầu nối động mạch quay (RA) cho thấy một cầu nối bắc cầu có đường kính nhỏ. Cầu nối này xuất hiện thông thoáng.
(D) Hình ảnh tái tạo đa mặt phẳng dạng đường cong (Curved MPR) cho thấy một cầu nối tĩnh mạch hiển (SVG) được lấp đầy thuốc tương phản với hai túi phình nhỏ (outpouchings), một túi phình ở đoạn gần và một túi phình ở đoạn giữa đến đoạn xa của cầu nối tĩnh mạch hiển, nghi ngờ là túi giả phình mạch (pseudoaneurysms) (các mũi tên cong).
Động mạch quay (Radial Artery)
Động mạch quay (RA – radial artery) lần đầu tiên được giới thiệu như một ống dẫn động mạch (arterial conduit) cho phẫu thuật bắc cầu động mạch vành (CABG) bởi Carpentier và các cộng sự vào đầu những năm 1970. Tắc nghẽn cầu nối sớm (Early graft occlusion) và sự xuất hiện của co thắt mạch máu (vasospasm) dẫn đến việc loại bỏ động mạch quay như một nguồn để tái thông mạch máu. Tuy nhiên, những tiến bộ gần đây trong kỹ thuật lấy động mạch quay giúp giảm thiểu tổn thương nội mô (endothelial damage) và việc sử dụng thuốc chẹn kênh canxi (calcium channel blockers) sau phẫu động thuật để giảm co thắt động mạch đã dẫn đến việc đưa động mạch quay (RA) trở lại như một lựa chọn cầu nối động mạch khả thi.
Động mạch quay (RA) được lấy từ tay không thuận của bệnh nhân và được sử dụng kết hợp với các cầu nối động mạch khác, hoặc dưới dạng cầu nối tự do (free graft) hay cầu nối tổng hợp (composite graft). Động mạch quay thường được dùng như một lựa chọn thay thế cho cầu nối tĩnh mạch hoặc khi cần cầu nối thứ ba. Động mạch quay thường được sử dụng nhất như một ống dẫn độc lập (independent conduit) để tưới máu cho vùng cấp máu của tim trái. Tuy nhiên, động mạch quay cũng có thể được sử dụng như một phần của cấu hình chữ Y hoặc một cầu nối để tưới máu cho động mạch vành phải (RCA) đoạn xa hoặc động mạch liên thất sau (PDA) (xem Hình 2; Hình 3).
Tỷ lệ thông thoáng trong ngắn hạn (short-term) được báo cáo của động mạch quay (RA) có thể so sánh với tỷ lệ thông thoáng của động mạch vú trong trái (LIMA). Trong khi đó, tỷ lệ thông thoáng trung hạn (mid-term) đến dài hạn (long-term) là 89% sau 4 năm, tương tự như tỷ lệ thông thoáng của cầu nối tĩnh mạch hiển (SVG). Đường kính của động mạch quay (RA) tương tự như đường kính của động mạch vú trong (IMA) trên hình chụp CTA khi động mạch quay đi từ động mạch chủ lên (ascending aorta) đến mạch máu đích bị tắc nghẽn. Do đặc điểm cấu trúc cơ của động mạch quay, việc đánh giá trên hình chụp CTA có thể bị hạn chế do số lượng clip phẫu thuật cần thiết nhiều hơn để nối các nhánh bên so với cầu nối động mạch vú trong (IMA).
Hình 3. Bệnh nhân nữ 60 tuổi được chụp CTA mạch vành (Cardiac CTA) 1 tuần sau khi phẫu thuật bắc cầu động mạch vành (CABG).
(A) Hình ảnh tái tạo thể tích (VR) 3D cho thấy sự tái thông động mạch toàn bộ (total arterial revascularization) của thất trái bằng việc sử dụng động mạch vú trong trái (LIMA) (các mũi tên) và động mạch quay (RA) (đầu mũi tên) để tạo thành một cầu nối bắc cầu tổng hợp hình chữ Y (Y composite bypass graft). Cầu nối động mạch quay bên trái tự do (free left RA) đoạn gần được nối với đoạn giữa của động mạch vú trong trái (LIMA) và đoạn xa RA nối với một nhánh động mạch bờ tù (OM branch) (không hiển thị ở đây). Động mạch vú trong trái (LIMA) xuất phát từ động mạch dưới đòn trái và đoạn xa của LIMA nối với động mạch liên thất trước (LAD) (mũi tên cong).
(B, C) Hình ảnh tái tạo đa mặt phẳng dạng đường cong (Curved MPR) cho thấy động mạch vú trong trái (LIMA) được lấp thuốc tương phản tốt (các mũi tên) kèm với động mạch quay (RA) được nối tận-bên (end-to-side) (các đầu mũi tên). Việc đánh giá chỗ nối đoạn gần của động mạch quay nối vào đoạn giữa của LIMA bị hạn chế do có các clip phẫu thuật trong vùng này. Tuy nhiên, sự lấp thuốc tương phản của động mạch quay (RA) cho thấy cầu nối thông thoáng.
Động mạch vị mạc nối phải (R-GEA: right gastroepiploic artery)
Pym và cộng sự cùng với Suma và cộng sự đã mô tả một cách độc lập việc sử dụng động mạch vị mạc nối phải (R-GEA) làm cầu nối trong phẫu thuật bắc cầu động mạch vành (CABG) vào năm 1987. Động mạch vị mạc nối phải (R-GEA) được sử dụng như cầu nối được lựa chọn thứ hai hoặc thứ ba cho tái thông mạch máu cơ tim toàn bộ hoặc khi không còn cầu nối khả thi nào khác (Hình 4).
Động mạch vị mạc nối phải (R-GEA) có cấu trúc mô học tương tự như các động mạch vú trong (IMA), nhưng những khó khăn trong phẫu thuật lấy động mạch vị mạc nối phải cùng với các biến chứng ở bụng chu phẫu (perioperative) và lâu dài đã hạn chế việc sử dụng nó. Hiếm khi, R-GEA được nối tại chỗ (in situ) với đoạn gần của nó từ bờ cong lớn (greater curvature) của dạ dày đến nối vào đoạn xa của động mạch liên thất sau (PDA). Trên hình chụp CTA, động mạch vị mạc nối phải (R-GEA) được thấy đi phía trước gan và xuyên qua cơ hoành đến nối với động mạch đích bị tắc nghẽn.
Hình 4. Bệnh nhân nam 69 tuổi có tiền sử phẫu thuật bắc cầu mạch vành (CABG) trước đây, hiện có tổn thương mới với hẹp nặng đoạn gần của động mạch liên thất trước (LAD). Bệnh nhân đã trải qua một cuộc phẫu thuật bắt cầu mạch vành (CABG) khác bằng việc sử dụng cầu nối động mạch vị mạc nối phải (R-GEA).
(A) Hình ảnh tái tạo thể tích (VR) 3D cho thấy cầu nối động mạch vị mạc nối phải (R-GEA) kéo dài từ dưới cơ hoành để nối vào đoạn xa của động mạch liên thất trước (LAD) ở phía trước (các mũi tên).
(B, C) Các hình ảnh trên mặt phẳng axial của tầng bụng trên cho thấy cầu nối động mạch vị mạc nối phải được lấp thuốc tương phản tốt (mũi tên) đi lên phía trên vào lồng ngực.
Các động mạch khác
Xu hướng hiện nay trong phẫu thuật bắc cầu mạch vành là đánh giá các cầu nối động mạch dựa trên tỷ lệ thông thoáng vượt trội lâu dài của động mạch vú trong (IMA) so với cầu nối tĩnh mạch. Các động mạch khác gồm động mạch trụ (ulnar), động mạch vị trái (left gastric), động mạch lách (splenic), động mạch ngực lưng (thoracodorsal) và động mạch mũ đùi ngoài (lateral femoral circumflex) đã được sử dụng trong những trường hợp không có cầu nối động mạch thay thế nào khác. Động mạch thượng vị dưới (inferior epigastric artery) cũng được xem xét là một lựa chọn thay thế làm cầu nối với những kết quả đầy hứa hẹn đã được báo cáo.
Biến chứng (Complications)
Huyết khối và tắc nghẽn cầu nối (Graft Thrombosis and Occlusion)
Các biến chứng liên quan đến phẫu thuật bắc cầu mạch vành (CABG) có thể xảy ra ở giai đoạn cấp hoặc mạn tính. Trong giai đoạn cấp (trong vòng 1 tháng sau khi phẫu thuật bắc cầu mạch vành), teo cầu nối tĩnh mạch (vein graft attrition) do huyết khối (thrombosis) hình thành từ tổn thương nội mô trong quá trình lấy cầu nối tĩnh mạch và sự nối thông của các mạch máu là nguyên nhân chính gây thất bại cầu nối (graft failure).
Những bệnh nhân có tình trạng tăng đông máu (hypercoaguable state) hoặc chấn thương cơ học (mechanical trauma) do kéo căng (pulling) và giằng co (stretching) của các cầu nối có chiều dài quá ngắn, dẫn đến kích hoạt dòng thác động máu (coagulation cascade), góp phần làm tăng tỷ lệ tắc nghẽn cầu nối trong tháng đầu tiên sau phẫu thuật. Từ 3% đến 12% cầu nối tĩnh mạch hiển (SVG) bị tắc nghẽn trong vòng tháng đầu tiên sau phẫu thuật.
Tăng sản nội mạc tân sinh (Neointimal hyperplasia) do cầu nối tĩnh mạch tiếp xúc với tuần hoàn động mạch là nguyên nhân chính gây ra huyết khối cầu nối tĩnh mạch sau này. Sau tháng đầu tiên sau phẫu thuật, cầu nối tĩnh mạch có nội mạc dày lên, gây ra hẹp lòng mạch lên đến 25%. Sau đó, sự tăng sinh (proliferation) và di chuyển (migration) của tế bào cơ trơn đến lớp nội mạc dẫn đến phát triển mảng xơ vữa (atheroma), cuối cùng gây ra tắc nghẽn cầu nối sau đó. Ngược lại thì cầu nối động mạch vú trong (IMA) có khả năng chống lại sự phát triển của xơ vữa động mạch (atherosclerosis) một cách đáng kể, mang lại tỷ lệ thông thoáng lâu dài tốt hơn so với cầu nối tĩnh mạch hiển (SVG). Vị trí nối thông của đoạn xa với động mạch vành tự nhiên (native coronary artery) là một vị trí phổ biến xảy ra xơ vữa động mạch, dẫn đến thất bại cầu nối IMA sau này.
Hẹp và tắc nghẽn cầu nối có thể được xác định và mô tả bằng hình chụp CTA. Sau khi xác định được mảng xơ vữa có vôi hóa (calcified atherosclerotic plaque) hoặc không vôi hóa (noncalcified), mức độ hẹp lòng mạch được phân tích bằng các phương pháp định tính (qualitative) hoặc định lượng (quantitative). Cầu nối bị tắc nghẽn hoàn toàn có thể không được thấy trên CTA hoặc có thể xuất hiện dưới dạng gián đoạn đột ngột, thường là ở đoạn gần của lòng mạch có lấp thuốc tương phản. Trong nhiều trường hợp, chỉ đoạn gần của chỗ nối được thấy rõ khi nó lấp thuốc tương phản để tạo thành hình ảnh phình ra (outpouching), dạng nút (button), hoặc dạng mẩu cụt (nubbin) đặc trưng (Hình 5). Hẹp cầu nối được đặc trưng bởi hình khuyết thuốc trong lòng mạch (intraluminal filling defect) với sự thay đổi về đường kính của mạch máu.
Hình 5. Bệnh nhân nam 74 tuổi sau can thiệp mạch vành qua da (PCI) với đặt stent và phẫu thuật bắc cầu mạch vành (CABG), nhập viện với triệu chứng đau ngực mới khởi phát.
(A) Hình ảnh tái tạo đa mặt phẳng dạng đường cong (Curved MPR) và (B) hình ảnh tái tạo dạng đường thẳng (linear reformatted images) của động mạch mũ trái (LCX) với 2 stent ở đoạn gần và đoạn giữa mạch máu cho thấy các vùng có mảng xơ vữa không vôi hóa trong lòng mạch (noncalcified intraluminal plaques) (các mũi tên) và các mảng xơ vữa vôi hóa ngoài lòng mạch (calcified extraluminal plaques) (các đầu mũi tên). Mạch máu đoạn xa có kích thước nhỏ (các mũi tên đặc), cũng có thể cho thấy tái hẹp trong stent đoạn gần (proximal in-stent restenosis).
(C, D, E) Các hình ảnh tái tạo thể tích (VR) 3D cho thấy hình ảnh điển hình của cầu nối tĩnh mạch hiển (SVG) (các mũi tên) đi phía sau nhĩ phải và vị trí nối với động mạch liên thất sau (PDA). Cũng có 2 cầu nối tĩnh mạch hiển trái đã bị tắc nghẽn xuất phát từ phía trước trái của động mạch chủ lên cho thấy dấu hiệu mỏm cụt (nubbin sign) (các mũi tên cong). Tình cờ ghi nhận động mạch liên thất trước (LAD) có hình dạng không đều (các mũi tên đặc) phù hợp với bệnh lý xơ vữa động mạch nhiều.
(F) Hình ảnh tái tạo đa mặt phẳng dạng đường cong (Curved MPR) cho thấy cầu nối tĩnh mạch hiển (SVG) lấp đầy thuốc tương phản với chỗ nối đoạn xa kiểu tận – bên (end-to-side) thông thoáng đến động mạch liên thất sau (PDA) (mũi tên). Cũng ghi nhận động mạch vành phải (RCA) có hình dạng không đều (mũi tên đặc) với nhánh bờ nhọn (AM acute marginal branch) thông thoáng (đầu mũi tên).
Sai vị trí cầu nối (Graft Malposition)
Một nguyên nhân sớm gây thất bại trong tái thông mạch vành cơ tim là do cầu nối bị sai vị trí (malpositioning) hoặc gập góc (kinking) khi cầu nối quá dài. Cầu nối quá ngắn thường bị kéo căng, là biến chứng thường gặp ở những bệnh nhân có phổi ứ khí (hyperinflated lungs), như bệnh nhân bị bệnh phổi tắc nghẽn mạn tính (COPD). Lựa chọn kỹ thuật nối cũng có thể góp phần gây gập góc cầu nối. Nếu vị trí đoạn gần của cầu nối gắn vào động mạch chủ không được hỗ trợ đầy đủ thì cầu nối có thể bị gập góc. Tình trạng gập góc này thường có thể được quan sát trên chụp cắt lớp vi tính mạch vành (CTA).
Co thắt cầu nối (Graft Vasospasm)
Mối lo ngại chính sau phẫu thuật đối với cầu nối động mạch là co thắt mạch (vasospasm). Đặc biệt, động mạch quay (RA) với thành cơ dày nên rất dễ bị co thắt. Các báo cáo cho thấy rằng việc sử dụng thuốc chẹn alpha-adrenergic trong phẫu thuật và dùng thuốc chẹn kênh canxi sau phẫu thuật có hiệu quả trong việc ngăn ngừa co thắt cầu nối. Dấu hiệu liên quan trên CTA là giảm đáng kể đường kính lòng mạch mà không có bằng chứng khuyết thuốc trong lòng mạch.
Phình mạch cầu nối (Graft Aneurysm)
Hai loại phình mạch liên quan đến phẫu thuật bắc cầu mạch vành (CABG) đã được báo cáo trong y văn: phình mạch thật (true aneurysms) và giả phình mạch (pseudoaneurysms). Phình mạch thật có bản chất là xơ vữa động mạch (atherosclerotic) và thường xuất hiện 5 đến 7 năm sau phẫu thuật CABG. Giả phình mạch có thể xảy ra sớm sau khi phẫu thuật do nhiễm trùng hoặc kéo căng tại vị trí nối mạch, cũng như vào thời điểm muộn hơn. Giả phình mạch xuất hiện muộn có khả năng liên quan đến thay đổi xơ vữa động mạch. Chụp CTA ban đầu có thể cho thấy một tổn thương ở trung thất (mediastinal lesion) gây hiệu ứng khối (mass effect) (Hình 6).
Phình mạch nên được đánh giá về độ thông thoáng (patency), kích thước, và hiệu ứng khối lên các cấu trúc lân cận. Mặc dù chưa có sự đồng thuận về việc điều trị phình mạch nhưng việc can thiệp để ngăn ngừa biến chứng có thể được xem xét dựa trên biểu hiện lâm sàng của bệnh nhân và kích thước phình mạch. Các biến chứng của phình mạch cầu nối bao gồm thuyên tắc (embolization) cầu nối, nhồi máu cơ tim (myocardial infarction), hình thành lỗ dò (fistula formation), vỡ phình mạch gây tràn máu màng ngoài tim (hemopericardium), tràn máu màng phổi (hemothorax), hoặc tử vong.
Hình 6. Bệnh nhân nam 69 tuổi có tiền sử phẫu thuật bắc cầu mạch vành (CABG), nhập viện với triệu chứng đau lưng mới khởi phát.
(A, B) Hình ảnh CTA mạch vành mặt phẳng axial cho thấy 2 cầu nối tĩnh mạch hiển (SVG) thông thoáng ở đoạn gần tại vị trí xuất phát từ phía trước của động mạch chủ lên (các đầu mũi tên). Tuy nhiên, cầu nối tĩnh mạch hiển đến động mạch liên thất sau (PDA) bị huyết khối ở đoạn xa hơn (mũi tên đặc). Ngoài ra, cầu nối tĩnh mạch hiển đến động mạch liên thất trước (LAD) có một túi giả phình lớn, bị huyết khối một phần (các mũi tên). Tình cờ ghi nhận các lá nội mạc (Intimal flaps) (các mũi tên cong) trong động mạch chủ ngực xuống.
Tràn dịch màng ngoài tim (Pericardial Effusions) và tràn dịch màng phổi (Pleural Effusions)
Tỷ lệ tràn dịch màng ngoài tim sau phẫu thuật tim (cardiac surgery) lên tới 85%. Tình trạng này còn được gọi là hội chứng sau mở màng ngoài tim (postpericardiotomy syndrome), được phát hiện trên lâm sàng khi bệnh nhân xuất hiện suy tim, khó chịu ở ngực, và có tiếng cọ màng ngoài tim (pericardial rub) khi thăm khám thực thể (physical examination). Tràn dịch màng ngoài tim có thể tiến triển thành chèn ép tim cấp (cardiac tamponade) ở 0.8% đến 6% bệnh nhân.
Hội chứng sau mở màng ngoài tim (Postpericardiotomy syndrome) thường là bệnh lý có sốt do phản ứng viêm liên quan đến màng phổi hoặc màng ngoài tim. Hội chứng này đã được báo cáo ở những bệnh nhân được mở màng ngoài tim, cũng như là một biến chứng bất thường sau các thủ thuật can thiệp qua da như đặt stent mạch vành (coronary stent implantation) và đặt dây dẫn máy tạo nhịp qua tĩnh mạch (transvenous pacemaker lead implantation).
Điều trị thuốc chống đông sau phẫu thuật và rối loạn đông máu là các yếu tố nguy cơ. Tràn dịch màng ngoài tim có thể dẫn đến chèn ép tim cấp sớm hoặc muộn sau phẫu thuật và thậm chí là chèn ép tim tái phát. Sốt, khó thở, đau ngực kiểu màng phổi (pleuritic chest pain) và nôn ói (emesis) là các triệu chứng lâm sàng điển hình liên quan đến hội chứng này; và nhịp tim nhanh (tachycardia) kèm theo tiếng cọ màng phổi (pleural friction rub) cũng là một dấu hiệu kinh điển. Trong hầu hết các trường hợp, tình trạng này là tự giới hạn, mặc dù thuốc chống viêm có thể được sử dụng để hỗ trợ quá trình hồi phục.
Khoảng 89% bệnh nhân trải qua phẫu thuật bắc cầu mạch vành (CABG) có tràn dịch màng phổi sau phẫu thuật. Triệu chứng chính là khó thở kèm đau ngực, và sốt là triệu chứng không điển hình. Hầu hết các trường hợp tràn dịch là lượng ít, ở bên trái và tự hết.
Nhiễm trùng xương ức (Sternal Infection)
Nhiễm trùng vết mổ xương ức sau phẫu thuật bắc cầu mạch vành (CABG) xảy ra ở 1% đến 20% bệnh nhân. Một số yếu tố nguy cơ đóng vai trò trong sự xuất hiện nhiễm trùng vết mổ xương ức bao gồm đái tháo đường (diabetes mellitus), béo phì (obesity), nam giới (male gender), thời gian và độ phức tạp của ca phẫu thuật, và truyền máu (blood transfusions). Viêm trung thất (Mediastinitis) là một biến chứng nặng của nhiễm trùng vết mổ sâu ở xương ức với tỷ lệ tử vong khoảng 22%.
Hình ảnh CT có thể đóng vai trò không thể thiếu trong việc đánh giá và mô tả đặc điểm viêm trung thất sau phẫu thuật tim. Sự biến mất các lớp mỡ ở trung thất và thâm nhiễm mô mềm lan tỏa có hoặc không có tụ khí (gas collections) là những dấu hiệu gợi ý viêm trung thất.
Các dấu hiệu phát hiện tình cờ (Incidental Findings)
Mặc dù vai trò chính của chụp CTA mạch vành sau phẫu thuật bắc cầu mạch vành (CABG) là để đánh giá sự thông thoáng cầu nối nhưng bệnh lý ngoài tim có thể được phát hiện ở vùng ngực và vùng bụng trên trong trường khảo sát. Sự hiện diện của các dấu hiệu ngoài tim trên CTA đã được báo cáo rõ ràng trong y văn. Các dấu hiệu ngoài tim đã được ghi nhận ở 13.2% bệnh nhân được chụp CTA tim trong giai đoạn ngay sau phẫu thuật.
Các dấu hiệu phát hiện tình cờ bao gồm thuyên tắc phổi (pulmonary embolism), nốt ở phổi, viêm phổi, tắc nghẽn đàm nhớt (mucous plugging), tràn khí màng phổi, và bóc tách động mạch chủ (xem Hình 6). Do đó, các dấu hiệu không liên quan đến tim có ý nghĩa lâm sàng phải được các bác sĩ chẩn đoán hình ảnh phân tích kỹ lưỡng để đảm bảo không bỏ sót các dấu hiệu quan trọng.
Stents mạch vành (Coronary stents)
Giới thiệu
Can thiệp mạch vành qua da (PCI – Percutaneous coronary intervention) gồm đặt stent mạch vành, là thủ thuật không phẫu thuật chính để tái thông mạch vành cơ tim, với ước tính có khoảng 652.000 trường hợp đặt stent động mạch vành ở Hoa Kỳ vào năm 2006. PCI được chỉ định lâm sàng ở những bệnh nhân có các triệu chứng khác nhau của thiếu máu cơ tim cục bộ hoặc nhồi máu cơ tim, hoặc ở những bệnh nhân sau phẫu thuật bắc cầu mạch vành (CABG) mà có các yếu tố nguy cơ chống chỉ định cho việc phẫu thuật tái thông mạch.
Hai loại stent chính được sử dụng trong can thiệp mạch vành qua da (PCI) là stent kim loại trần không phủ thuốc (BMS – bare-metal stents) và stent phủ thuốc (DES – drug-eluting stents). Mặc dù stent có tỷ lệ tái hẹp thấp hơn so với nong mạch vành bằng bóng (balloon angioplasty), nhưng tình trạng tái hẹp trong stent (in-stent restenosis) và huyết khối (thrombosis) trong stent vẫn còn là vấn đề. Chụp mạch vành (CA – Coronary angiography) là tiêu chuẩn vàng để đánh giá stent trong mạch vành nhưng đây là thủ thuật xâm lấn (invasive) và có liên quan đến các biến chứng trong và sau phẫu thuật. Đánh giá không xâm lấn bằng chụp cắt lớp vi tính đa dãy (MDCT) có thể là một lựa chọn thay thế để phát hiện tái hẹp trong stent (xem Hình 5).
Tuy nhiên, khả năng của chụp cắt lớp vi tính đa dãy (MDCT) trong việc đánh giá chính xác lòng stent động mạch vành có thể bị hạn chế bởi các xảo ảnh kim loại (stent artifacts) của stent, tình trạng mà có thể làm mờ lòng stent. Ngoài ra, hiệu ứng nở hoa (blooming effect) gây ra bởi các stent kim loại cản quang (radio-opaque metal stents) có thể làm phóng đại kích thước của khung stent (stent struts) dẫn đến đánh giá sai lệch về độ hẹp của lòng stent. Các máy chụp MDCT 64 lát cắt thế hệ mới hơn với độ phân giải thời gian và không gian cao hơn tạo ra hình ảnh trực tiếp lòng stent và đánh giá sự thông thoáng trong stent với chất lượng cao hơn. Một nghiên cứu gần đây nhằm đánh giá tính hữu ích của chụp CTA 64 lát cắt trong việc đánh giá sự thông thoáng của stent động mạch vành đã báo cáo độ nhạy và độ đặc hiệu đối với tình trạng tái hẹp trong stent lần lượt là 89% và 95%.
Hình ảnh stent mạch vành (Stent Imaging)
Độ chính xác chẩn đoán của MDCT trong việc đánh giá sự thông thoáng của stent phụ thuộc vào nhiều yếu tố khác nhau, bao gồm đường kính, vật liệu và thiết kế của stent. Các hình ảnh tái tạo đa mặt phẳng (MPR) và hình ảnh cắt ngang (cross-sectional) được sử dụng để tạo ra hình ảnh và đánh giá chính xác sự thông thoáng của stent, tái hẹp hoặc tăng sản nội mạc tân sinh (neointimal hyperplasia). Ngoài ra, việc mô tả đặc điểm của kiểu bắt thuốc tương phản trong lòng stent là rất quan trọng trong phân tích sự thông thoáng của stent (Hình 7).
Stent mạch vành được coi là bị tắc nghẽn nếu mất hoàn toàn sự lấp thuốc tương phản bên trong lòng stent kèm theo giảm hoặc không có dòng chảy ở đoạn sau stent (distal runoff), cho thấy tái hẹp trong stent nặng. Việc thấy thuốc tương phản trong mạch máu đoạn sau stent không phải lúc nào cũng cho thấy sự thông thoáng của stent vì có thể đây là do dòng chảy ngược (retrograde filling) của các mạch máu bàng hệ xung quanh đi vào.
Mức độ của xảo ảnh (artifacts) khác nhau tùy thuộc vào thành phần (composition) và loại stent được sử dụng. Phần lớn các stent được làm từ thép không gỉ (stainless steel), nhưng các vật liệu khác có thể bao gồm tantalum, hợp kim coban, platinum, nitinol và titanium. Stent làm bằng tantalum tạo ra xảo ảnh mạnh nhất, trong khi stent titan và nitinol gây ra ít xảo ảnh nhất.
Hình ảnh của stent trên CTA cũng phụ thuộc vào thiết kế của stent. Đường kính thanh chống của stent có thể ảnh hưởng đến độ lớn của xảo ảnh và hạn chế đánh giá chính xác sự thông thoáng của stent mạch vành. Một yếu tố khác góp phần vào khả năng quan sát lòng stent là đường kính stent. Nhìn chung, các stent có đường kính lớn hơn hoặc bằng 3.5 mm sẽ được hiển thị tốt hơn.
Hình 7. Bệnh nhân nam 75 tuổi có tiền sử can thiệp mạch vành qua da (PCI) với đặt stent mạch vành. Hình ảnh tái tạo đa mặt phẳng dạng đường cong (Curved MPR) cho thấy một stent lấp thuốc tương phản tốt ở đoạn gần của động mạch liên thất trước (LAD), phù hợp với stent thông thoáng mà không có bằng chứng của huyết khối hoặc tái hẹp trong stent.
Biến chứng của sau khi đặt stent mạch vành
Tái hẹp trong stent (in-stent restenosis)
Tái hẹp trong stent vẫn là một thách thức đối với hiệu quả lâu dài của can thiệp qua da tạo hình mạch vành trong lòng mạch (percutaneous transluminal coronary angioplasty – PTCA) và tái hẹp được định nghĩa là giảm 50% đường kính lòng mạch, mặc dù việc đánh giá mức độ hẹp này thường gặp khó khăn ở những stent có đường kính nhỏ (Hình 8).
Tỷ lệ tái hẹp trong stent sau 1 năm kể từ khi thực hiện PTCA dao động từ 8.6% đến 21.3%, và xảy ra do sự kết hợp của hiện tượng co lại đàn hồi (elastic recoil), tăng sinh tế bào cơ trơn, và tái cấu trúc thành mạch gây ra bởi chấn thương mạch máu tại chỗ.
Việc đặt stent mạch vành làm giảm tái hẹp (restenosis) bằng cách ngăn ngừa hiện tượng co lại đàn hồi của mạch máu ở giai đoạn sớm và tái cấu trúc thành mạch ở giai đoạn muộn sau khi tạo hình mạch vành nhưng có liên quan đến việc tăng sinh nội mạc mới (neointimal proliferation). Tỷ lệ tái hẹp trong stent dao động từ < 10% với stent phủ thuốc (DES) đến 40% với stent kim loại trần không phủ thuốc (uncoated metallic stents). Bệnh nhân bị tái hẹp trong stent thường có biểu hiện đau thắt ngực tái phát. Nong bóng tạo hình mạch vành (Balloon angioplasty) là thủ thuật thường được sử dụng nhất để điều trị tình trạng tái hẹp trong stent.
Hình 8. Bệnh nhân nữ 76 tuổi có tiền sử phẫu thuật bắc cầu mạch vành (CABG) và can thiệp mạch vành qua da (PCI) với nhiều vị trí đặt stent, nhập viện vì đau ngực mới khởi phát.
(A) Hình ảnh tái tạo đa mặt phẳng dạng đường cong (curved MPR) cho thấy cầu nối tĩnh mạch hiển (SVG) nối từ động mạch chủ lên đến đoạn xa của động mạch vành phải (RCA) có 2 stent trong lòng mạch. Có các vùng giảm đậm độ trong stent (các mũi tên) nhưng vẫn thấy thuốc tương phản ở đoạn xa, phù hợp với tình trạng tái hẹp một phần trong stent.
(B) Hình ảnh tái tạo đa mặt phẳng dạng đường cong (curved MPR) của stent bị huyết khối tại động mạch vú trong phải (RIMA), không thấy thuốc tương phản ở đoạn gần và bên trong stent (mũi tên). Tuy nhiên, có thuốc tương phản trong mạch máu phía sau stent (đầu mũi tên), khả năng cao là do dòng chảy ngược từ các nhánh mạch máu bàng hệ.
Huyết khối trong stent (In-stent thrombosis)
Huyết khối trong stent là một biến chứng hiếm gặp nhưng nghiêm trọng sau can thiệp mạch vành qua da (PCI) (xem Hình 8). Theo một nghiên cứu gần đây, tỷ lệ huyết khối trong stent dao động từ 1.3% đến 1.7% trong vòng 9 tháng theo dõi. Huyết khối trong stent cấp tính có thể xảy ra trong vòng 24 giờ sau can thiệp, trong khi huyết khối bán cấp thường xảy ra trong khoảng thời gian từ 1 đến 30 ngày sau khi đặt stent kim loại trần không phủ thuốc. Ngoài ra, stent phủ thuốc (DES) có liên quan đến huyết khối trong stent muộn, thường xảy ra sau 30 ngày kể từ khi can thiệp.
Sự xuất hiện của biến chứng huyết khối muộn này có liên quan đến quá trình nội mô hóa (endothelization) của stent do ngừng điều trị thuốc chống đông. Ngoài các yếu tố nguy cơ của bệnh nhân (suy thận, đái tháo đường, và giảm phân suất tống máu), các yếu tố làm tăng nguy cơ huyết khối trong stent sau khi đặt stent bao gồm chiều dài stent dài, với nguy cơ huyết khối tương đối được báo cáo là 1.03 cho mỗi chiều dài tăng thêm 1 mm.
Những tiến bộ gần đây
Những tiến bộ gần đây trong công nghệ hình ảnh đã mở rộng đáng kể khả năng của CT trong chẩn đoán hình ảnh mạch vành không xâm lấn.
Các dòng máy CT tiên tiến như CT 256 lát cắt và CT 320 lát cắt với phạm vi bao phủ theo chiều dọc lớn hơn và độ phân giải thời gian được cải thiện đã nâng cao chất lượng hình ảnh tim mạch một cách rõ rệt.
Gần đây, CT hai đầu dò (dual-source CT) đã trở thành công cụ nổi bật trong đánh giá động mạch vành ở những bệnh nhân có nhịp tim nhanh hoặc rối loạn nhịp tim, đồng thời cho phép đánh giá chức năng tâm thất toàn bộ (global ventricular function), vận động theo vùng của thành tim (regional wall motion), và các van tim (cardiac valves).
Việc sử dụng kỹ thuật đồng bộ theo chu kỳ tim theo kiểu tiến cứu (prospective gating) đã giúp giảm liều tia bức xạ cho bệnh nhân so với phương pháp đồng bộ theo chu kỳ tim hồi cứu (retrospective ECG gating) mà không làm giảm độ chính xác chẩn đoán của CTA mạch vành. Kỹ thuật này cũng có thể được áp dụng để đánh giá các cầu nối mạch vành và stent mạch vành. Nhược điểm chính của kỹ thuật này bao gồm cần phải có nhịp tim chậm và thiếu thông tin chức năng tim, vì chỉ chụp một phần của chu kỳ tim.
Hình ảnh tưới máu cơ tim (perfusion imaging) là một kỹ thuật mới xuất hiện, có thể cho phép đồng thời đánh giá hình thái cầu nối và stent, cũng như tình trạng cơ tim.
Tóm tắt
Công nghệ chụp cắt lớp vi tính đa dãy đầu dò (MDCT) đã được cải thiện đáng kể qua nhiều năm và thường là một phương pháp thay thế thực tế cho chụp động mạch vành xâm lấn trong việc đánh giá tình trạng thông thoáng của cầu nối và stent mạch vành. CTA tim cho phép đánh giá đồng thời các biến chứng sau đặt stent và các biến chứng sau phẫu thuật biểu hiện bằng đau ngực. Đối với phẫu thuật bắc cầu mạch vành (CABG), cần có sự hiểu biết về giải phẫu cầu nối mạch vành, loại phẫu thuật đã thực hiện, các dấu hiệu hẹp cầu nối và các dấu hiệu tiềm ẩn ngoài tim để có thể diễn giải chính xác.
Tài liệu tham khảo
Evaluation of Bypass Grafts and Stents
Người dịch: Bs. Lê Thị Ny Ny – Anhvanyds
Để lại một phản hồi Hủy